自己の不要な細胞との戦い ―壊死した細胞が引き起こす全身での炎症応答とエネルギー消費の異常―研究成果

自己の不要な細胞との戦い |
平成26年4月18日
東京大学大学院薬学系研究科
1.会見日時: 2014年 4月 14日(月)13:00 ~ 15:00
2.会見場所:文部科学省記者会(〒100-8959 東京都千代田区霞ヶ関 3-2-2 12階)
3.出席者: 三浦 正幸(東京大学大学院薬学系研究科薬科学専攻 教授)
小幡 史明 (東京大学大学院薬学系研究科薬科学専攻) 特任助教)
※東京大学・熊本大学が合同で行う記者会見となり、同会場で、熊本大学発生医学研究所 多能性幹細胞分野 粂 昭苑 教授も別の関連した研究成果を発表します。
4.発表のポイント:
◆ ショウジョウバエの中で翅の細胞で局所的にかつ人工的に周囲に炎症を引き起こしながら細胞が死に至るネクローシス(壊死)を誘導することに成功した。
◆ ネクローシスに反応してショウジョウバエの全身で自然免疫が活性化され、その結果、エネルギーの浪費とそれにブレーキをかける仕組みが働くことが示唆された。
◆ 本成果は、がんや糖尿病をはじめとしたさまざまな炎症が関わる疾患における新たな治療戦略の基礎となる知見となることが期待される。
5.発表概要:
生物の発生過程および生命維持過程においては、多くの不要な細胞が、プログラムされた細胞死(アポトーシス、注1)により除去されます。アポトーシスの機構がうまく働かない場合、周囲に炎症を引き起こしながら細胞が死に至る、ネクローシス(注2)が起こります。このネクローシスは、がん、虚血再還流による組織傷害、動脈硬化などさまざまな炎症をともなう疾患の病態にかかわっていることが示唆されています。しかし細胞がネクローシスした場合に、全身がどのように反応しているかはよく分かっていませんでした。
東京大学大学院薬学系研究科の小幡史明特任助教、三浦正幸教授らは、局所的かつ人工的にショウジョウバエの翅の細胞でネクローシスを引き起こすことに成功し、その結果、ショウジョウバエの全身で自然免疫が活性化することを明らかにしました。この活性化を引き金に脂肪体組織で転写因子が活性化し、エネルギーの浪費が引き起こされる一方で、この転写因子はエネルギーの浪費にブレーキをかける仕組みをも発動させることが示唆されました。
局所でのネクローシスによって全身のエネルギー代謝が調節される仕組みは、がんや糖尿病をはじめとした炎症をともなうさまざまな疾患の原因や悪化の制御要因に関与している可能性があり、新規の治療標的となる可能性を示唆しています。またこのショウジョウバエを利用した更なる解析によって、ネクローシスした細胞から放出される物質のうち、免疫応答を引き起こすものを同定することも可能であり、今後の進展が期待されます。
6.発表内容:
① 研究背景
生物の発生時および維持過程においては大量の細胞が不要になります。これらの細胞を除去する仕組みとして、あらかじめ死ぬことが決まった、プログラムされた細胞死(アポトーシス)が存在します。一方で、アポトーシスが阻害された場合には、ネクローシスと呼ばれ、炎症を惹起する細胞死が引き起こされ、これががん、虚血再還流による組織傷害、動脈硬化などさまざまな病気に関わることが示唆されています。しかしながらわたしたちの身体がどのようにしてネクローシス細胞に応答するのか、その過程は複雑な細胞間、組織間相互作用を含んでいるために解析が困難でした。
ショウジョウバエは幼虫から成虫になる過程で翅を作ります。成虫が羽化して直後は翅の中に上皮細胞が残っていますが、これらは翅が成熟する過程で数時間のうちに除去されます。つまり、翅の形成には細胞死が関わっており、この過程を人為的に操作することができれば、ショウジョウバエの翅細胞でネクローシスを引き起こすことができ、ネクローシスした細胞に対して全身がどのように応答するかを明らかにできる可能性があります。
② 研究内容
東京大学大学院薬学系研究科遺伝学教室の小幡史明特任助教、三浦正幸教授らは、ショウジョウバエを用いて翅細胞のアポトーシスを阻害することにより、翅細胞においてネクローシスを誘導することに成功しました。翅細胞においてのみアポトーシスを阻害すると翅の細胞がネクローシスし、それによってショウジョウバエの全身で炎症応答が惹起されることを明らかにしました(図1)。この炎症応答に加えて、エネルギー代謝が亢進し、貯蔵エネルギーを浪費していることが分かりました(図2)。この浪費は、ヒトの肝臓や脂肪組織にあたる脂肪体という組織において、炎症応答(Toll経路)に呼応して活性化したFoxOと呼ばれる転写因子タンパク質が(注3)原因で、その影響下で貯蔵エネルギーであるトリアシルグリセロールが減少することが見いだされました。一方で、代謝産物の網羅的な解析(メタボロミクス)から、メチオニンから合成されるSアデノシルメチオニン(SAM注4)代謝に異常があることが分かりました(図2)。SAMは活性化メチオニンと呼ばれ、体内のメチル化状態を規定する重要な代謝産物です。解析の結果、翅細胞のネクローシスによって引き起こされた炎症応答の影響でSAM量を制御するタンパク質Gnmt(注5)が脂肪体組織で過剰に産生されていることを見いだしました。興味深いことにGnmtは免疫の活性化、飢餓ストレスなどでも産生され、脂肪体という組織においてFoxOにより制御されていました。この結果から、GnmtによるSAM代謝制御はFoxOの活性化が引き起こすエネルギー浪費を抑えるブレーキとして機能していることが示唆されました。
③ 今後の展望
ネクローシスした細胞が炎症応答を引き起こすことは、ヒトの多くの疾患においてみられる現象です。したがって、局所のネクローシスにより引き起こされる脂肪体組織でのFoxO活性化とそれに伴うエネルギー浪費、SAM代謝亢進の仕組みは、がんや糖尿病をはじめとした炎症をともなうさまざまな疾患の原因や悪化の制御要因になる可能性があり、治療の標的としても期待されます。SAM代謝は、細胞の増殖、分化、細胞死と密接に関わっており、また近年注目されているエピジェネティクス(注6)に必須の因子です。そのため、炎症応答とSAM代謝が密接に関わることは、SAM代謝の変化がエネルギー代謝以外の影響でも病態の制御に関わる可能性があり、興味深い知見です。
ネクローシス細胞から放出される炎症応答を引き起こす物質を同定することで、新しい創薬標的を明らかにすることができます。また今回のモデルを利用して、炎症応答が引き起こすSAM代謝の制御を標的としたエネルギー代謝異常を治す薬のスクリーニング、SAM代謝産物を標的にした疾患の診断法開発も可能であり、その成果が期待されます。
本研究成果は、理化学研究所発生・再生科学総合研究センター・倉永英里奈チームリーダー(ショウジョバエ遺伝学的解析)、慶應義塾大学先端生命科学研究所・曽我朋義教授(メタボローム解析)、らとの共同研究として行われました。
本研究は、文部科学省科学研究費補助金基盤研究(S)「発生頑強性を規定する細胞死シグナルの解明」(研究代表者:三浦 正幸)と、科学技術振興機構(JST) CREST研究領域「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」(研究総括:永井 良三)における研究課題「個体における組織細胞定足数制御による恒常性維持機構の解明」(研究代表者:三浦 正幸)の支援を受けて行われました。
7.発表雑誌:
雑誌名:「Cell Reports」
出版・発行: 2014年4月17日(米国東部時間正午)
論文タイトル:Necrosis-driven systemic immune response alters SAM metabolism through the FOXO-GNMT axis.
著者: Obata, F., Kuranaga, E., Tomioka, K., Ming, M., Takeishi, A., Chen, C-H., Soga, T., and Miura, M.*(*:責任著者)
8.問い合わせ先:
東京大学大学院薬学系研究科 薬科学専攻 遺伝学教室
三浦 正幸(みうら まさゆき)教授
9.用語解説:
1)アポトーシス:プログラムされた細胞死の一種で、細胞が自分自身を破壊して死ぬ仕組み。不要な細胞やダメージを受けて修復不可能になった細胞を適切に除去する仕組みとして機能している。
2)ネクローシス:細胞壊死。アポトーシスと違い細胞の内容物を放出して周囲に炎症を引き起こす。物理的な損傷などによりおこる事故死であると捉えられていたが、最近では遺伝子によって制御されるネクローシスも多数報告されている。
3)FoxO:主にインシュリンにより制御をうける転写因子で、飢餓ストレスに応答して貯蔵されている脂質を分解する酵素を発現誘導しエネルギー作ったり、タンパク質の合成を制御してエネルギー消費を抑えたりする機能をもつ。さまざまなストレスによっても活性化される。
4)SAM:活性型メチオニンとも呼ばれ、DNAやRNAなどの核酸や種々のタンパク質のメチル化修飾に必要な代謝産物。必須アミノ酸であるメチオニンから合成されて、ポリアミンやシステインの原料となる。
5)Gnmt:グリシンNメチルトランスフェラーゼ。アミノ酸であるグリシンにメチル基を付与してサルコシンを合成する反応を担う。この過程でSアデノシルメチオニン(SAM)を消費するため、余分なSAMを消費してその量を制御する因子として機能する。
6)エピジェネティクス:遺伝子のDNA配列の変化をともなわず、DNAやそれに巻き付いているタンパク質、ヒストンの修飾等を介して遺伝情報が制御される仕組み。DNAやヒストンはSAM依存的にメチル化を受けてその機能を制御されることが明らかとなっている。
10.添付資料:
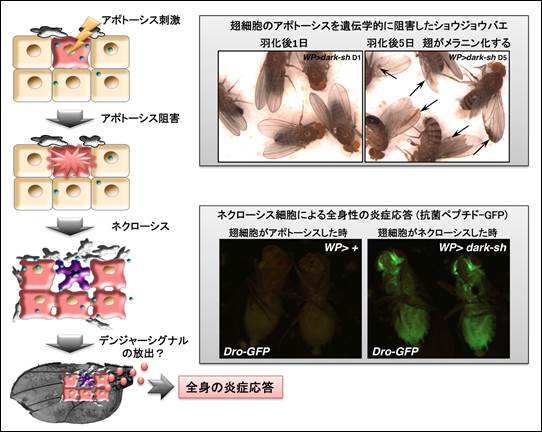
図1 翅のアポトーシス阻害によるネクローシス誘導
左:翅の細胞は成虫羽化後すぐにアポトーシスするよう刺激される。しかしこのときアポトーシスに必要な遺伝子を抑制すると、ネクローシスが誘導される。ネクローシスした翅の細胞は、何らかの因子(デンジャーシグナル;危険信号とよばれるものが想定される)を介して自然免疫系を活性化し、全身に散在する脂肪体という組織において炎症応答を惹起する。
右上:翅細胞のアポトーシスを阻害すると、羽化後5日間の間に次第に翅のメラニン化が見られる。メラニン化は損傷や感染時にみられる免疫応答である。
右下:翅細胞のネクローシスを阻害すると、全身にある脂肪体において炎症応答がおこる。 自然免疫応答の指標となる抗菌ペプチドを産生する時に緑色蛍光タンパク質が発現するように遺伝子操作し、ショウジョウバエの全身で起こる免疫応答を可視化した。
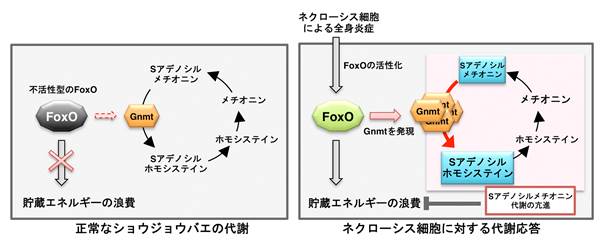
図2 ネクローシスをきっかけに見られる代謝異常
左:正常なショウジョウバエの代謝。FoxOと呼ばれる転写因子が不活性状態に維持されており、貯蔵エネルギーを維持している。この場合、Gnmtの発現が低く保たれており、SアデノシルメチオニンやSアデノシルホモシステインなどのメチオニン代謝産物の量が保たれている。
右:細胞のネクローシスにより全身の炎症状態が惹起されると、脂肪体組織においてFoxOが活性化する。活性化したFoxOはトリアシルグリセロール分解を促進して、貯蔵エネルギーを浪費するようになる。一方で、Gnmtの発現を促進して、Sアデノシルメチオニン代謝を亢進させる。この場合にGnmtの発現量を抑制すると、エネルギー浪費が加速するため、Sアデノシルメチオニン代謝の亢進はエネルギー浪費を抑えるメカニズムとして機能しているのではないかと示唆される。






