神経と筋肉のつなぎ目を大きくする治療法を創出 ― 多様な神経筋疾患に対する新たな治療概念の確立 ―研究成果

神経と筋肉のつなぎ目を大きくする治療法を創出 |
平成26年9月19日
東京大学医科学研究所
1.発表者:
山梨裕司 東京大学医科学研究所 腫瘍抑制分野 教授
有村純暢 東京大学医科学研究所 腫瘍抑制分野 助教
2.発表のポイント:
◆呼吸を含めた運動機能に必要な神経と筋肉のつなぎ目(神経筋接合部)を、後天的に拡張する技術をマウスにおいて創出しました。
◆神経筋接合部が小さくなる異常(形成不全)を伴う筋無力症などの神経筋疾患を発症したマウスの神経筋接合部を大きくすることで運動機能を改善し、延命しました。
◆本研究成果は、神経筋接合部の形成不全を伴う多様な神経筋疾患について新たな治療
概念を確立したものであり、根本的な治療法のない神経筋疾患への応用が期待されます。
3.発表概要:
私たちの運動機能には、運動神経を介した骨格筋収縮の緻密な制御が必要です。神経筋接合部(注1)は運動神経と骨格筋を結ぶ唯一の「絆」(神経筋シナプス)であり、その喪失は呼吸を含めた運動機能の喪失を意味します。東京大学医科学研究所の山梨裕司教授らの研究グループは、これまでに神経筋接合部の形成に必須のタンパク質としてDok-7を、また、そのヒト遺伝子(DOK7)の異常による劣性遺伝病として神経筋接合部の形成不全を呈するDOK7型筋無力症(注2)を発見しています。一方、神経筋接合部の形成不全は筋無力症のみならず、筋ジストロフィー、筋萎縮性側索硬化症(ALS)や加齢性筋肉減少症などの多様な神経筋疾患にも関与していますが、その治療標的としての可能性は未確認でした。
研究グループは、マウスを用いた実験から、DOK7発現ベクター(注3)の投与により神経筋接合部を後天的に拡張できることを確認し、また、DOK7型筋無力症を発症したマウスへの投与によりその運動機能を改善し、生存期間を延長しました。さらに、筋ジストロフィーの一種を発症しているマウスにおいても類似の効果を実証しました。
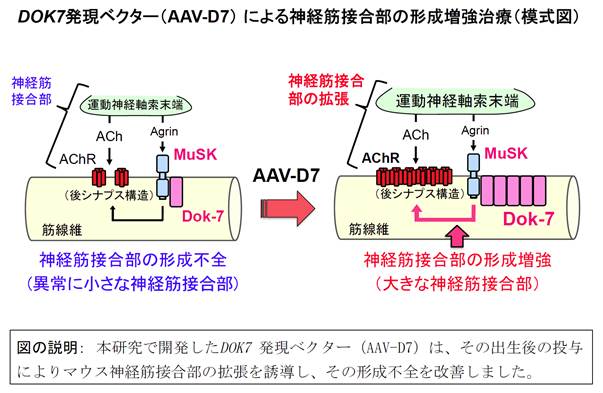
本研究の成果として、DOK7発現ベクターの投与による「神経筋接合部の形成増強治療」をマウスにおいて創出しました。この治療法を簡潔に表現すれば、「小さくなってしまった神経筋接合部を大きくする治療法」と言えます(図)。本成果は、神経筋接合部の形成不全を伴う多様な神経筋疾患に対する治療法の開発につながることが期待されます。
本研究は、文部科学省科学研究費補助金や橋渡し研究加速ネットワークプログラムなどの助成を受けて実施されました。
4.発表内容:
① 研究の背景・先行研究における問題点
私たちが呼吸をし、活動するためには、運動神経によって骨格筋収縮を緻密に、素早く制御する必要があります。この時、運動神経からの制御シグナルは神経筋接合部という特殊な構造(神経筋シナプス)を介して骨格筋に伝達されます(神経筋伝達)。哺乳動物の神経筋接合部はひとつの筋線維の中央部分にひとつだけ形成されるかけがえのない「絆」であり、その喪失は呼吸を含めた運動機能の喪失を意味します。研究グループは、これまで神経筋接合部の形成に必須のタンパク質としてDok-7を(Science 312:1802-1805, 2006)、ヒトDOK7遺伝子の異常による劣性遺伝病としてDOK7型筋無力症を発見し、それが神経筋接合部の形成不全病であることを解明しています(Science 313:1975-1978, 2006)。その他にも、研究グループはDok-7タンパク質の機能解析から、このタンパク質が神経筋接合部の形成に必要な、筋線維に特異的に発現する受容体(受容体型チロシンキナーゼMuSK)に必須の細胞内活性化因子であることを突き止めています(Science Signaling 2:ra7, 2009)。
一方で、神経筋接合部の形成不全は、筋無力症の他、現在まで根本的な治療法が見つかっていない、筋ジストロフィー、筋萎縮性側索硬化症(ALS)、脊髄性筋萎縮症(SMA)や加齢性筋肉減少症(サルコペニア)などの多様な神経筋疾患への関与が報告されています。しかし、その治療標的としての可能性については未解明の点が数多く残されていました。
② 研究内容(具体的な手法など詳細)
本研究では、Dok-7タンパク質の発現を人為的に増強する手法として、ヒト骨格筋での安全性、かつ、長期にわたって外来遺伝子を発現することに優れたアデノ随伴ウイルス(AAV: adeno-associated virus)をベクターとして採用することとし、ヒトDOK7遺伝子を発現するAAVベクター(AAV-D7)を作製しました。このAAV-D7を正常なマウスに投与すると、投与後数日で神経筋接合部の拡張が確認されました。そこで、DOK7型筋無力症に見られる遺伝子変異と同じ遺伝子変異を導入したDOK7型筋無力症モデルマウス(注4)を作製し、その発症後にAAV-D7を投与したところ、形成不全を呈する神経筋接合部が拡張し、マウスの運動機能も改善しました(図)。また、このモデルマウスは、疾患の発症(9日齢)から死亡(20日齢以前)までが極めて短いにも関わらず、発症後にAAV-D7を投与するとその致死性は回避され、運動機能は投与後数週間で正常レベルに回復し、1年以上の延命効果を示しました。そこで、DOK7型筋無力症とはその原因において無関係の、しかし、神経筋接合部の形成不全を伴う点では共通する神経筋疾患モデルとして、核内分子をコードするLMNA遺伝子の異常によって発症する常染色体優性エメリー・ドレフュス型筋ジストロフィー(AD-EDMD: autosomal dominant Emery-Dreifuss muscular dystrophy)のモデルマウスにもその発症後にAAV-D7を投与しました。その結果、発症後(16日齢)のAAV-D7の投与によって、形成不全を呈する神経筋接合部が拡張され、運動機能が改善されることが判明しました。なお、AD-EDMDのモデルマウスの延命効果は30日程度であることが分かりましたが、併発する心機能障害(心不全)によって死に至る可能性も示唆されました。この点では、AD-EDMD患者の心機能障害にはペースメーカーや植込み型除細動器による治療が効果的であることから、根本的な治療法のない筋力低下を標的とする本治療との併用がAD-EDMDの効果的な治療になる可能性もあります。
③ 社会的意義・今後の予定など
以上の通り、本研究グループは、1)哺乳動物の神経筋接合部を後天的、人為的、かつ安全に拡張する方法を創出し、2)神経筋接合部の形成不全を伴う多様な神経筋疾患に対する新規な治療概念を確立しました。特に、後者の観点からは、AAV-D7と同様に、神経筋接合部を拡張できる他の治療薬の開発にも道を拓く発見と言えます。それ故に、今回創出した神経筋接合部の形成増強治療の適応・不適応を筋萎縮性側索硬化症(ALS)や加齢性筋肉減少症(サルコペニア)を含む多様な疾患モデル動物(注4)で検証する研究や、臨床への橋渡し研究(注5)の推進が急がれます。なお、本治療法は神経そのものや筋肉そのものなど、神経筋接合部以外を標的とする他の治療技術との併用も期待できることを付記します。
5.発表雑誌:
雑誌名:「Science」(2014年9月19日版)
http://www.sciencemag.org
論文タイトル:
DOK7 gene therapy benefits mouse models of diseases characterized by defects in the neuromuscular junction
著者:
Sumimasa Arimura, Takashi Okada, Tohru Tezuka, Tomoko Chiyo, Yuko Kasahara, Toshiro Yoshimura, Masakatsu Motomura, Nobuaki Yoshida, David Beeson, Shin’ichi Takeda and Yuji Yamanashi
6.問い合わせ先:
東京大学医科学研究所腫瘍抑制分野
教授 山梨 裕司(やまなし ゆうじ)
7.用語解説:
(注1)神経筋接合部:運動神経からの制御シグナルを骨格筋(筋線維)に伝える唯一の化学シナプスであり、NMJ(neuromuscular junction)とも呼ばれます。ヒトを含む哺乳動物では各筋線維の中央部にひとつだけ形成され、運動神経の軸索末端から放出されるアセチルコリン(ACh)が筋線維の後シナプス部位に凝集しているアセチルコリン受容体(AChR)を刺激することで骨格筋の収縮が誘導されます(図)。
(注2)筋無力症、DOK7型筋無力症:筋無力症は神経筋接合部の異常が直接の原因となって発症する神経筋疾患の総称で、易疲労性の筋力低下を特徴とし、重篤例では呼吸不全により死に至ります。研究グループが発見したDOK7型筋無力症は先天性筋無力症に分類される劣性遺伝病であり、神経筋接合部の大きさが健常者の半分程度に小さくなる神経筋接合部の形成不全による疾患です。やはり、重篤例では呼吸不全により死に至ります。
(注3)ベクター:遺伝子を用いた治療法においては、標的とする細胞・組織に特定の遺伝子を発現させるもの(運搬体)を意味します。本研究ではアデノ随伴ウイルスがDOK7遺伝子を発現させるための運搬体として使われており、それ故、ベクターとして扱われます。
(注4)疾患モデルマウス(動物):ヒト疾患の病因・病態を高度に再現するマウス(動物)の総称であり、発症機構の解明や予防・治療・診断等の非臨床試験に用いられます。
(注5)橋渡し研究:トランスレーショナルリサーチとも呼ばれ、本研究のように「神経筋接合部の形成機構の解明」という基礎研究そのものでもなく、また、「神経筋疾患の治療」という典型的な臨床研究でもなく、その両者に橋を渡す研究を意味します。
8.添付資料: