Toll様受容体8はRNAの分解物を認識する ~ウリジンが活性化に必須~研究成果

Toll様受容体8はRNAの分解物を認識する |
平成27年1月20日
東京大学大学院薬学系研究科
1.発表者:
清水 敏之(東京大学大学院薬学系研究科 教授)
丹治 裕美(東京大学大学院薬学系研究科 修士2年)
大戸 梅治(東京大学大学院薬学系研究科 講師)
2.発表のポイント:
◆進入してきたウイルスや細菌から生体を守るために、Toll様受容体8 (TLR8)という自然免疫応答を引き起こすタンパク質があります。
◆TLR8に一本鎖RNA(注1)が結合した状態の詳細な三次元構造と、その活性化には一本鎖RNAと一本鎖RNAが分解されて生じるウリジンとの協調的な作用が関わっていることを明らかにしました。
◆本成果は、TLR8を標的とした抗がん剤や自己免疫疾患治療薬などの開発につながることが期待されます。
3.発表概要:
東京大学大学院薬学系研究科の清水敏之教授、丹治裕美大学院生、大戸梅治講師および同医科学研究所の三宅健介教授、柴田琢磨助教らの研究グループは、病原体由来の一本鎖RNAを感知して自然免疫系を活性化するToll様受容体8(TLR8)が一本鎖RNAを認識する様子の詳細な三次元構造を世界で初めて解明しました。
私たちの体には、病原体に対する防御機構として自然免疫機構が備わっています。病原体は主にTLR受容体と呼ばれるタンパク質が感知しており、炎症反応などを起こすことで生体を病原体から守っています。TLR受容体には病原体由来の一本鎖RNAを感知するもの(TLR7とTLR8)が知られており、ウイルス感染や自己免疫疾患などの病態に関わっていることがわかっていました。しかしTLR7やTLR8がどのようにして一本鎖RNAを認識しているのかは不明でした。
今回、研究グループは、TLR8と一本鎖RNAが結合した状態(複合体)の詳細な三次元構造を明らかにしました。その結果、TLR8は一本鎖RNAだけを認識しているのではなく、一本鎖RNAと、一本鎖RNAが分解されて生じるウリジン(注2)という低分子の両者を同時に異なる部位で認識しており、これらの協調的な作用によって活性化されることがわかりました。またこの観測事実はTLR8がRNAとは構造的にも化学的にも大きく性質の異なる物質によっても活性化されるという謎を解明するものでもあります。
本研究の成果は、TLR8を標的とした抗がん剤や自己免疫疾患の治療薬などの開発につながることが期待されます。
なお、本成果は首都大学東京大学院理工学研究科の磯辺俊明特任教授、田岡万悟助教、山内芳雄特任研究員らのグループとの共同研究によるものです。
4.発表内容:
病原体に対する防御機構として、私たちの体には自然免疫機構が備わっています。TLR受容体は自然免疫系の受容体であり、病原体の持つ特定の分子パターンを認識しています。TLR受容体が活性化すると、自然免疫が発動して炎症反応や抗ウイルス応答が起こり、病原体を排除します。TLR受容体はI型膜貫通タンパク質(注3)であり、細胞外のロイシンリッチリピート(LRR)ドメイン(注4)で分子パターンを認識して細胞外から細胞内へ情報を伝達しています。
TLR7およびTLR8は、HIV-1やA型インフルエンザウイルスなどの一本鎖RNAを認識し、最終的に抗ウイルス応答を引き起こすTLR受容体です。一方で、生体自身の死細胞などから放出されるRNAにも反応して異常な炎症応答を引き起こし、自己免疫疾患などを引き起こすことが知られています。これまで、TLR7およびTLR8がどのようにして一本鎖RNAを認識するのかについて、詳細な機構は不明でした。さらにこれらのTLRは一本鎖RNAとは構造的にも化学的にも大きく性質の異なる化学合成リガンド(注5)でも活性化されますが、この機構は大きな謎でした。
本研究グループは、一本鎖RNA に結合した状態のTLR8 (一本鎖RNA結合型TLR8 、3種)、およびウリジンに結合した状態のTLR8(ウリジン結合型TLR8)の結晶構造を明らかにすることに成功しました。結晶からの回折像の測定には、大型放射光施設SPring-8および高エネルギー加速器研究機構フォトンファクトリーの強力なX線を使用し、1.9~2.6 A(オングストローム、1 Aは10ナノメートル)という高い分解能で構造を決定しました。
構造解析の結果、一本鎖RNA結合型TLR8とウリジン結合型TLR8は、いずれもTLR8が2分子結合した活性化型の2量体構造であることがわかりました(図1)。一本鎖RNA結合型TLR8の構造から、TLR8には一本鎖RNAそのものは結合しておらず、その分解産物であるウリジン(モノヌクレオシド)と オリゴヌクレオチドをそれぞれ別々の部位(第一結合部位、第二結合部位)で認識していることがわかりました。第一結合部位は合成低分子化合物の結合部位に相当し、2量体界面に存在していました。第二結合部位は今回の研究で新たに見つかった結合部位でTLR8のLRR構造の内側にあり、2量体界面から離れた場所に存在していました。また、ウリジン結合型TLR8の構造では、第一結合部位にウリジンが結合していました。TLR8とモノヌクレオシドやモノヌクレオチドとの結合の強さを測定したところ、これらの中でウリジンが最も強く結合すること、および一本鎖RNA存在下ではウリジンの結合が増強されることが明らかになりました。
これらの結果から、TLR8の活性化は、一本鎖RNAとその分解産物のウリジンによる協調的な効果によって引き起こされることが明らかになりました(図2)。またTLR8の化学合成リガンドはウリジンと類似しており、両者が同様にTLR8を活性化するという謎を解明するものでもあります。
病原体由来のRNAを認識するTLR7およびTLR8は、ウイルス感染や自己免疫疾患、さらにはがんに至るまで、さまざまな疾患に関わっていることがわかっています。しかし、TLR7やTLR8の一本鎖RNAの具体的な認識機構はこれまで不明であり、それらの疾患の発症機構の解明は困難でした。これまでTLR8は一本鎖RNAを認識する受容体だと考えられていましたが、今回の結果からウリジンも同時に認識していることが明らかになりました。このことは、TLR8を標的にした創薬において、2つの部位で制御するという新しい視点を取り入れた治療薬開発に応用できると期待されます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)、科学研究費補助金、公益財団法人武田科学振興財団助成金、公益財団法人持田記念医学薬学振興財団助成金などの外部資金支援を受けて行われたものです。
5.発表雑誌:
雑誌名:Nature Structural & Molecular Biology
論文タイトル:Toll-like receptor 8 senses degradation products of single-stranded RNA
著者:丹治裕美*、大戸梅治*、柴田琢磨、田岡万悟、山内芳雄、礒邉俊明、三宅健介、清水敏之†(*共同筆頭著者、†責任著者)
DOI番号:10.1038/nsmb.2943
6.問い合わせ先:
東京大学大学院薬学系研究科
教授 清水 敏之 (しみず としゆき)
7.用語解説:
(注1)一本鎖RNA :二本鎖を構成していないRNAである。遺伝情報をRNAとして保持するウイルス(RNAウイルス)は一本鎖RNAウイルスと二本鎖RNAウイルスに分けられる。
(注2)ウリジン :RNAを構成する成分の一つであり、ウラシル(塩基)とリボース(糖)が結合した構造を持つ。
(注3)I型膜貫通タンパク質 :タンパク質のN末端側が細胞外に、C末端側が細胞内に配置している1回膜貫通型タンパク質。
(注4)ロイシンリッチリピート(LRR)ドメイン :保存されたロイシンを含む20~30残基のアミノ酸配列が複数連なって形成される領域である。全体として馬蹄形の構造を形成する。
(注5)リガンド :特定の受容体(receptor; レセプター)に特異的に結合する物質。TLR8では天然に存在するRNA以外に人工的に合成されたある種の化合物もリガンドとなることが知られている。
8.添付資料:
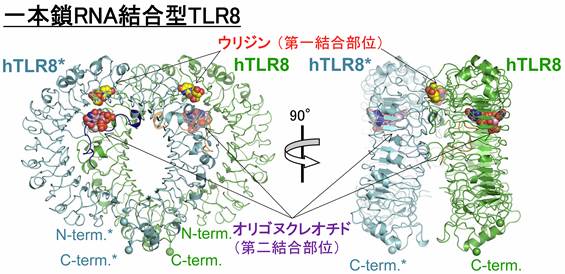
図1: 一本鎖RNA結合型TLR8の全体構造
2量体を構成しているTLR8分子の一方を緑色、他方を青色で示している。リガンド結合部位は赤文字で示した第一結合部位, および紫文字で示した第二結合部位の二箇所であり、それぞれウリジンおよびオリゴヌクレオチドが結合していた。
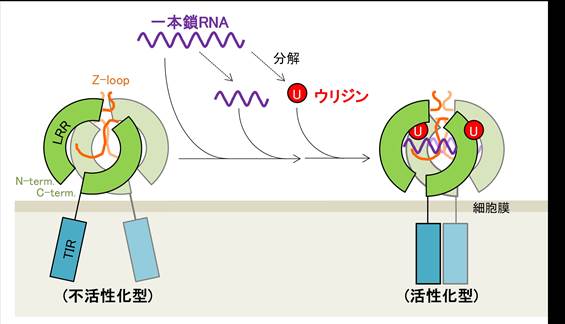
図2:一本鎖RNAによるTLR8の活性化機構
一本鎖RNAによるTLR8の活性化機構のモデル図。一本鎖RNAの分解産物であるウリジンは第一結合部位に、一本鎖RNAやその分解産物であるオリゴヌクレオチドは第二結合部位にそれぞれ結合し、協調的にTLR8を活性化する。






