ウイルス・バクテリア感染における新たな免疫応答制御機構を解明 自己免疫抑制機構の解明や感染症の治療法確立に期待

JST課題達成型基礎研究の一環として、東京大学生産技術研究所・分子免疫学分野の根岸英雄特任助教、柳井秀元特任助教らの研究グループは、ウイルスとバクテリアの重複感染によって重篤な症状が引き起こされる分子機構の一つを解明しました。ウイルスに感染した患者が、さらなるバクテリアの感染によって、非常に重篤な症状を起こす事が広く知られていますが、その背後にある分子機構についてはよく分かっていませんでした。
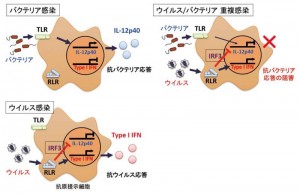
ウイルス、バクテリア感染ではそれぞれ異なった受容体経路が強く活性化され、病原体に応じた適切な免疫応答が活性化される(左)。ウイルスに感染した状態ではIL-12p40遺伝子が抑制された状態にあり、抗バクテリア応答ができない(右)。そのため、ウイルスに感染したマウスは極微量のバクテリアの感染に対しても高い感受性を示す。
本研究グループは、ウイルスに対して活性化する生体の防御応答が、同時にバクテリアに対する防御応答を抑制する性質を持っていることを発見しました。さらにその分子制御機構について詳細に調べたところ、ウイルス由来の核酸により強力に活性化されるIRF3という転写因子が、ウイルスを攻撃するために必須であるインターフェロン(IFN)の遺伝子を活性化する一方、バクテリアを攻撃するために重要なIL-12p40の遺伝子を抑制するという二面性があることが新たに判明しました。この機構により、ウイルスに感染したマウスではバクテリア感染に対する免疫応答が強く抑制されることが明らかとなりました。IRF3による抗バクテリア応答抑制機構は免疫応答の弱点とも言え、様々なウイルス/バクテリアによる重複感染症に関与していると考えられます。一方で、IL-12p40はT細胞応答を制御する重要な遺伝子であり、T細胞応答が引き起こす様々なアレルギー・自己免疫疾患に関与すると考えられています。そのため、今後、この仕組みをさらに詳細に解析することによって、アレルギー・自己免疫疾患抑制機構の理解や様々な重複感染症の治療法の確立に繋がる可能性があります。
なお本研究は、本研究グループが東京大学 大学院医学系研究科 免疫学教室在籍中に行われたもので、東京大学 大学院医学系研究科 免疫学教室の本田賢也准教授、中島啓研究員らと共同で行ったものです。
本研究成果は、2012年 5月20日18時(英国時間)に英国科学誌「Nature Immunology」のオンライン速報版で公開されました。
論文情報
Hideo Negishi, Hideyuki Yanai, Akira Nakajima, Ryuji Koshiba, Koji Atarashi, Atsushi Matsuda, Kosuke Matsuki, Shoji Miki, Takahiro Doi, Alan Aderem, Junko Nishio, Stephen T Smale, Kenya Honda & Tadatsugu Taniguchi,
“Cross-interference of RLR and TLR signaling pathways modulates antibacterial T cell responses”,
Nature Immunology Online Edition: 21 May 2012 (Japan time), doi: 10.1038/ni.2307.
論文へのリンク