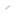筋肉タンパク質の協同的な力を発生させる機構を解明 綱引きチームのように振る舞うミオシン分子

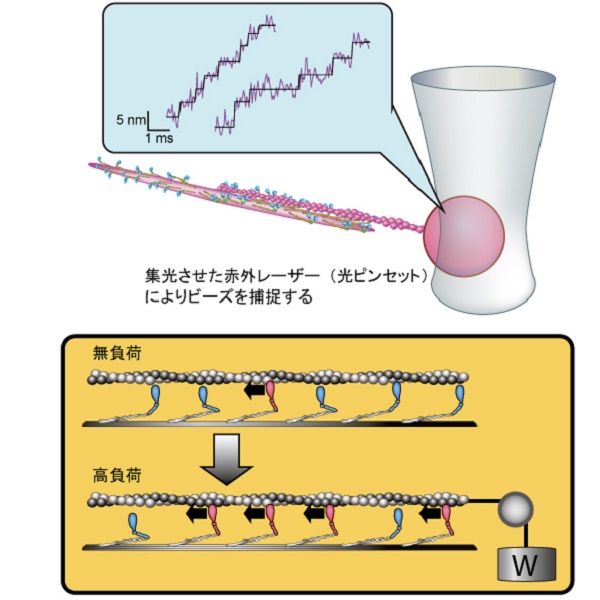
ミオシンフィラメントの力計測実験および協同的な力発生のイメージ図
ミオシンフィラメントがアクチンに相互作用する際の力を光ピンセットで計測した(上段)。生理条件に近いATP濃度において、アクチンの変位は1ミリ秒前後の時間間隔で5ナノメートル前後のステップ状に変化しており(上段)これらのデータ解析とシミュレーションから、負荷の増加に伴いミオシン分子間の力発生が同調し、その分子数も増える協同的な力発生とその分子機構が明らかになった(下段)。
© 2017 茅元司
東京大学大学院理学系研究科の茅元司助教と樋口秀男教授らの研究グループは、筋肉の収縮を担う骨格筋のミオシンと呼ばれるタンパク質が集合体を形成して力を出す際に、作用する負荷が上昇すると分子間の力発生が同調する現象を発見し、その分子機構を解明しました。このような力発生により、筋肉は効率的な収縮を実現していると考えられ、本結果が今後、効率的に機能するマイクロマシンや人工筋肉の開発につながると期待されます。
骨格筋は身体運動から、眼球の動きや目のピント調節、さらには言葉の滑舌に関わる舌の動きに至るまで様々な機能に深く関わっています。この筋肉の収縮は、ミオシンが約300分子程度集合したフィラメントを形成し、アクチンと呼ばれる他のタンパク質と相互作用して力を出すことで達成されます。
そこでグループは、「分子集団として力を出すことに特化した特性があるのでは?」という疑問のもと、アクチン1本と相互作用できるミオシンが約20分子程度集合した極微のミニフィラメントを合成し、アクチンに直径400ナノメートル(1ナノメートルは10億分の1メートル)のビーズを固定し,その動きからミオシン分子の動きと発する力を測りました。その結果,アクチンが5ナノメートル前後の幅でステップ状に変化している様子をエネルギー源となる化合物アデノシン三リン酸(ATP)の濃度が生理的条件において捉えることに初めて成功しました。特に高負荷におけるステップは、エネルギー効率の観点から複数のミオシン分子がほぼ同調して力を出さないと起こり得ないものであることが分かりました。この現象を理解するため、シミュレーションを構築した結果、負荷が増加するとミオシン各分子が力発生する前の状態に留まることで同調して力発生する確率をあげ、綱引きチームのように協同的な力発生を実現していることが判明しました。この研究から,元来はランダムに機能しているミオシンですが,負荷の増加を感知する機構により、分子間の力発生が同調する効率的な力発生の原理が見えてきました。
「全速力で走る運動も眼球内の水晶体の位置を動かすのも筋肉で、その基本構造は全く同じ構造であることはすごいなと思います。その分子メカニズムを紐解きたいと思って研究を続けています」と茅助教は話します。
「こんな高負荷でもアクチンの変位がステップ状に変化するのはミオシン同士が同期して力を出さないと起こらないと考え、そのメカニズムを探ろうと更なる実験とシミュレーションを繰り返し、理解を深めることができました」と樋口教授も話します。
論文情報
, "Coordinated force generation of skeletal myosins in myofilaments through motor coupling", Nature Communications Online Edition: 2017/07/06 (Japan time), doi:10.1038/NCOMMS16036.
論文へのリンク(掲載誌)