バイオ燃料生産の鍵となる酵素のしくみがあきらかに 微生物によるセルロース分解の「ミッシングリンク」

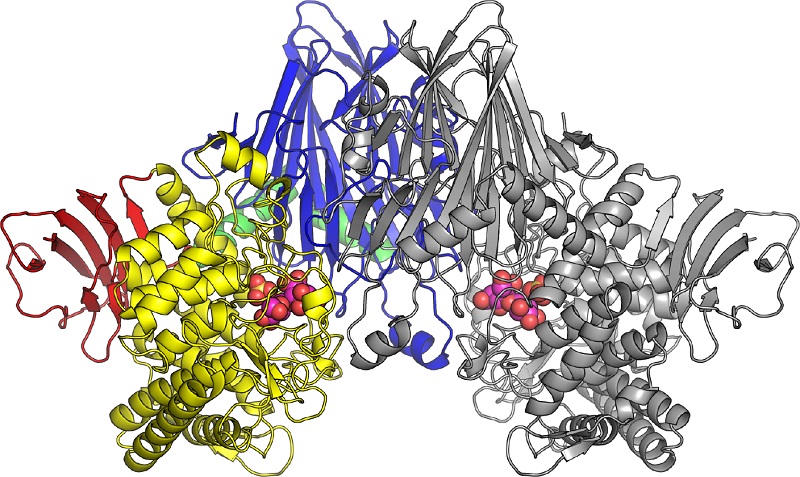
セロビオン酸ホスホリラーゼの立体構造
セロビオン酸ホスホリラーゼは二つの酵素分子が結合した二量体の状態で存在する。左半分の色のついた部分と、右半分の灰色の部分がそれぞれ一つの酵素分子を示す。セロビオン酸ホスホリラーゼに結合したセロビオン酸と硫酸イオン(リン酸類似化合物)は図内で球として表している。
© 2015 伏信進矢
東京大学大学院農学生命科学研究科の伏信進矢教授らの研究グループは、バイオ燃料生産の鍵となる酵素(セロビオン酸ホスホリラーゼ(CBAP))の立体構造とその作用メカニズムを初めて明らかにしました。本成果はバイオマスからバイオ燃料やさまざまな化学製品を作る技術を開発する上で重要な基礎的情報となります。
これまで細胞壁の主成分であるセルロースの微生物による分解には主に加水分解酵素(セルラーゼ)が関わるとされていました。近年、セルラーゼの活性効率を飛躍的に増大させる酸化的セルロース分解酵素の存在が注目されています。セルロースがこれらの酵素により分解されると、セロビオン酸ができますが、それがどのように代謝されるかは全く分かっていませんでした。
そのような背景のもと、本研究グループの一員でもある新潟大学大学院自然科学研究科の中井博之准教授が2013年に新しい酵素、セロビオン酸ホスホリラーゼを発見しました。セロビオン酸ホスホリラーゼがセロビオン酸に作用すると、発酵に利用されやすい化合物に分解されます。この酵素は微生物による酸化的セルロース分解と発酵の代謝経路をつなぐ、いわば「ミッシングリンク」のような存在でした。しかし、その立体構造は分かっておらず、どのようなメカニズムでセロビオン酸を分解しているかは不明でした。
今回、研究グループは海洋性細菌由来のセロビオン酸ホスホリラーゼの立体構造を、X線結晶構造解析により初めて解明しました。また、セロビオン酸と結合した状態のセロビオン酸ホスホリラーゼの立体構造も明らかにし(図)、セロビオン酸を分解するメカニズムが明らかになりました。
「本成果は、学術的に興味深い結果が得られたというだけではなく、微生物を利用してセルロースを分解し、エタノールなどのバイオ燃料やさまざまな化合物を発酵生産する「バイオリファイナリー」の技術開発においても、重要な情報をもたらすでしょう」と伏信教授は話します。
論文情報
, "Crystal structure and substrate recognition of cellobionic acid phosphorylase playing a key role in oxidative cellulose degradation by microbes", The Journal of Biological Chemistry Vol. 290, No. 30, pg 18281-18292, doi:10.1074/jbc.M115.664664.
論文へのリンク(掲載誌)