外科手術を行う夢のナノマシーンに向けた第一歩 生体内分子機械である「シャペロニンタンパク質」のチューブ状集積体がATPを検知し、薬剤を放出する

化学的安定性が低い核酸医薬などの薬剤は、その高い効能を発揮する前に生体内の輸送過程で分解されてしまう。そのため、不安定な薬剤を安定に腫瘍細胞へ配達できるようなドラッグデリバリーシステムの開発が強く求められている。
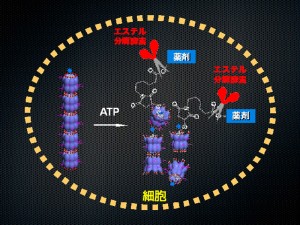
© Takuzo Aida. GroELが集合してできたナノチューブ型分子ロボットは細胞内に取り込まれると、ATPと結合し、チューブ構造がばらばらに分解される。その結果、薬剤が導入されたゲストタンパク質が細部内環境に放出され、細部内に存在するエステル分解酵素によって薬剤がゲストタンパク質から切り離され、薬剤が細胞内に配達される。
東京大学大学院工学系研究科化学生命工学専攻相田卓三教授(理化学研究所 創発物性科学研究センター 副センター長を兼任)らは、生体内に普遍に存在するアデノシン三リン酸(ATP)という物質の量を診断し、細胞内でのみ選択的に薬剤を放出できるナノチューブ型分子ロボットの開発に成功した。相田教授らはシャペロニン(GroEL)というタンパク質複合体の(1)ゲスト(変性タンパク質など)をシャペロニン内に取り込む性質、(2)ATPをエネルギー源として自身の機械的開閉運動を引き起こす性質、に着目した。そして、シャペロニン内に薬剤を取り込ませ、チューブ状(1次元状)に集合させた後、これにATPを添加すると、シャペロニンの構造変化が引き金となり、チューブ構造がばらばらに分解し、内包していた薬剤が放出されることを見出した。特に、チューブを壊すには1分子の機械的運動では不十分なため、薬剤放出が開始されるには然るべきATPの濃度が必要となる。細胞内においてATPは1-10 mM(ミリモル毎リットル)もの高濃度なのに対し、細胞外マトリックスにおいては5 μM(マイクロモル毎リットル)と格段に低い。この濃度差と、上記の放出機構を利用することで、ATPの濃度を診断し細胞内にのみ薬剤を選択的に放出する分子ロボットの開発に成功した。開発したナノチューブ型ロボットは、マウスに投与すると肝臓細胞に次いでがん細胞に多く取り込まれることが明らかとなり、ドラッグデリバリーシステムとして有望な結果が観測されている。
シャペロニンはその構造的安定性が非常に高いため、シャペロニン内に取り込まれた薬剤は安定に腫瘍細胞に配達できることが期待される。本成果は、がん治療薬として期待されるsiRNAなど、生体内では不安定な核酸医薬を腫瘍細胞に運搬するシステムの開発に繋がる可能性がある。
論文情報
Shuvendu Biswas, Kazushi Kinbara, Tatsuya Niwa, Hideki Taguchi, Noriyuki Ishii, Sumiyo Watanabe, Kanjiro Miyata, Kazunori Kataoka, Takuzo Aida,
“Biomolecular robotics for chemomechanically driven guest delivery fuelled by intracellular ATP”,
Nature Chemistry Online Edition: 2013/6/2 (Japan time), doi: 10.1038/nchem.1681.
論文へのリンク