胃がんを引き起こすピロリ菌がんタンパク質の立体構造解明 -胃がんの新たな予防・治療法開発に期待-

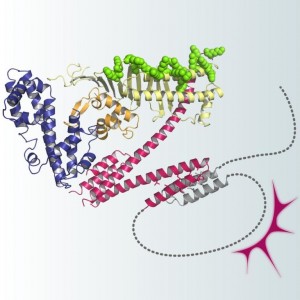
ピロリ菌がんたんぱく質CagAは固い構造を有する体部(全体の70%)と天然変性構造からなる尾部(全体の30%)から構成される © 畠山 昌則
体部は3つの構造ドメインから成り,ドメイン2とドメイン3はN字型の固いコアを形成する。ドメイン2には細胞膜のリン脂質と結合する塩基性パッチが存在する。固有の構造を持たない可動性のCagA尾部は、ドメイン3に付着することにより投げ縄様のループを形成する。この分子内相互作用の結果、CagAと標的分子(PAR1やSHP2)間の複合体形成がより安定化し、発がん活性が増大する。
全世界部位別がん死亡の第2位を占める胃がんはピロリ菌感染により引き起こされます。ピロリ菌が産生するCagAは胃がん発症に中心的な役割を担うがんタンパク質と考えられています。CagAはヒトの胃の細胞内に侵入後、様々なヒトタンパク質と相互作用しそれらの機能を障害することにより、胃細胞のがん化を促します。しかしながら、CagAの発がん活性を担う三次元的な分子構造基盤はこれまで全く不明でした。
今回、東京大学大学院医学系研究科の畠山昌則教授と産業技術総合研究所の千田俊哉主任研究員らの研究グループは、X線結晶構造解析と核磁気共鳴(NMR)法を駆使して、CagAの立体構造の解明に成功しました。
彼らは、CagA分子が、既知のタンパク質構造と類似性を全く示さないN字型の固いコア部分をもつ「CagA体部」と、固有の構造を持たず可動性に富む天然変性構造の「CagA尾部」から成っていることを発見し、さらに、CagA尾部がCagA体部に付着してループを構成する結果、発がん活性が増強するとい分子スイッチ機構の存在を初めて明らかにしました。
本研究の成果を通して、ピロリ菌による胃がん発症機構の理解が大きく進展するとともに、胃がんに対する革新的な分子標的治療・予防法開発につながることが期待されます。本研究は米国科学誌「Cell Host & Microbe誌」7月19日号に掲載されます。
論文情報
Takeru Hayashi, Miki Senda, Hiroko Morohashi, Hideaki Higashi, Masafumi Horio, Yui Kashiba, Lisa Nagase, Daisuke Sasaya, Tomohiro Shimizu, Nagarajan Venugopalan, Hiroyuki Kumeta, Nobuo N. Noda, Fuyuhiko Inagaki, Toshiya Senda, Masanori Hatakeyama,
“Tertiary Structure-Function Analysis Reveals the Pathogenic Signaling Potentiation Mechanism of Helicobacter pylori Oncogenic Effector CagA”,
Cell Host & Microbe Online Edition: 2012/7/19 (Japan time), doi: 10.1016/j.chom.2012.05.010.
論文へのリンク