自然免疫で働く細胞内センサーの詳細な構造 ADPが介在してNOD2の不活性型が維持されている

今回明らかにしたNOD2の立体構造
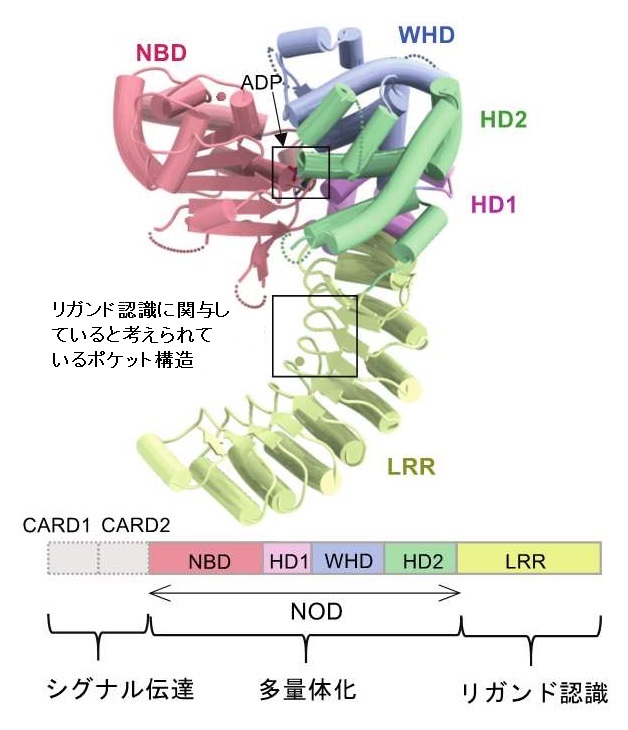
NOD2は複数のドメインから構成されており、ドメインごとに色を変えて表示しています。下方のカラーバーはNOD2の各ドメインの機能を表しています。
© 2016 清水敏之
東京大学大学院薬学系研究科の清水敏之教授の研究グループは、病原体の感染を察知する細胞内センサータンパク質の一種であるNOD様受容体の立体構造を世界で初めて明らかにました。本成果は、NOD様受容体が活性化される機構の解明や、病原体を感知する仕組みを解明していく上で重要な構造基盤となると期待されます。
私たちの体は細菌やウイルスなどの病原体の感染を防ぐ仕組みが備わっており、病原体の感染を察知する細胞内センサータンパク質が存在します。このような細胞内センサータンパク質の一つにヌクレオチド結合性多量体ドメイン(NOD)様受容体(NLR)と呼ばれるタンパク質群があります。このタンパク質群は病原体の痕跡や異物を認識(リガンド認識)することにともない複数結合した構造(多量体)を形成することで活性化し、細胞内に病原体感染の情報を伝達することが知られています。しかし、その立体構造については明らかになっていないものがあり、立体構造があきらかになることで、NLRの役割の理解が深まると考えられていました。
今回研究グループは、NLRの一つとして知られているNOD2が細胞のエネルギー源であるADPと結合しかつ、活性が失われた状態における立体構造をX線結晶構造解析を用いて明らかにしました。その結果、ADPはNOD2内の異なる機能をもつ領域(ドメイン)間の相互作用を媒介するように結合していること、またLRRと呼ばれるドメインにはリガンド認識に関わると推測される穴のような構造(ポケット)が見つかりました。
NOD2にはDNAの塩基配列が一つだけ異なる一塩基多型(SNPs)が多く報告されており、NOD2の一塩基多型は、ブラウ症候群やクローン病といった自己炎症性疾患に関連していることが知られています。そのため、研究グループは、今回明らかにした立体構造情報をもとに、一塩基多型とこれら疾患との関連についても考察しました。
「自然免疫系で働くセンサーのうちNLRはその構造的理解は遅れていました。今回の知見はNLRの制御機構解明に向けた大きな一歩です」と清水教授は話します。「さらに研究を続けて活性化状態のNOD2の構造を解明したい」と続けます。
論文情報
, "Crystal structure of NOD2 and its implications in human disease", Nature Communications: 2016/6/10 (Japan time), doi:10.1038/ncomms11813.
論文へのリンク(掲載誌)






