核酸系抗生物質ヒキジマイシンの収束的全合成に成功 強力な生物活性を有する複雑な天然物の完全化学合成
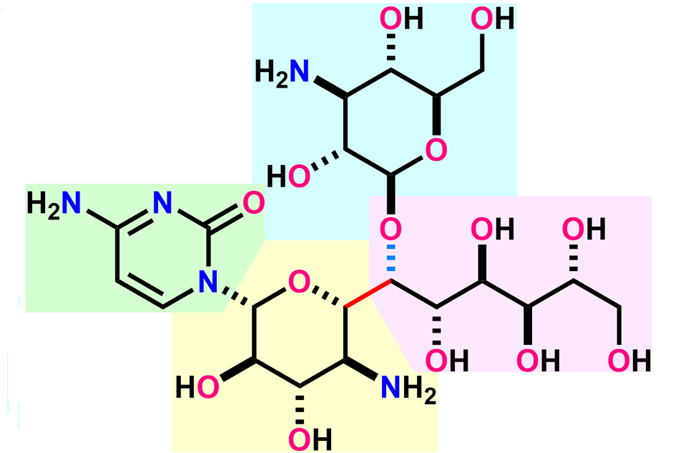
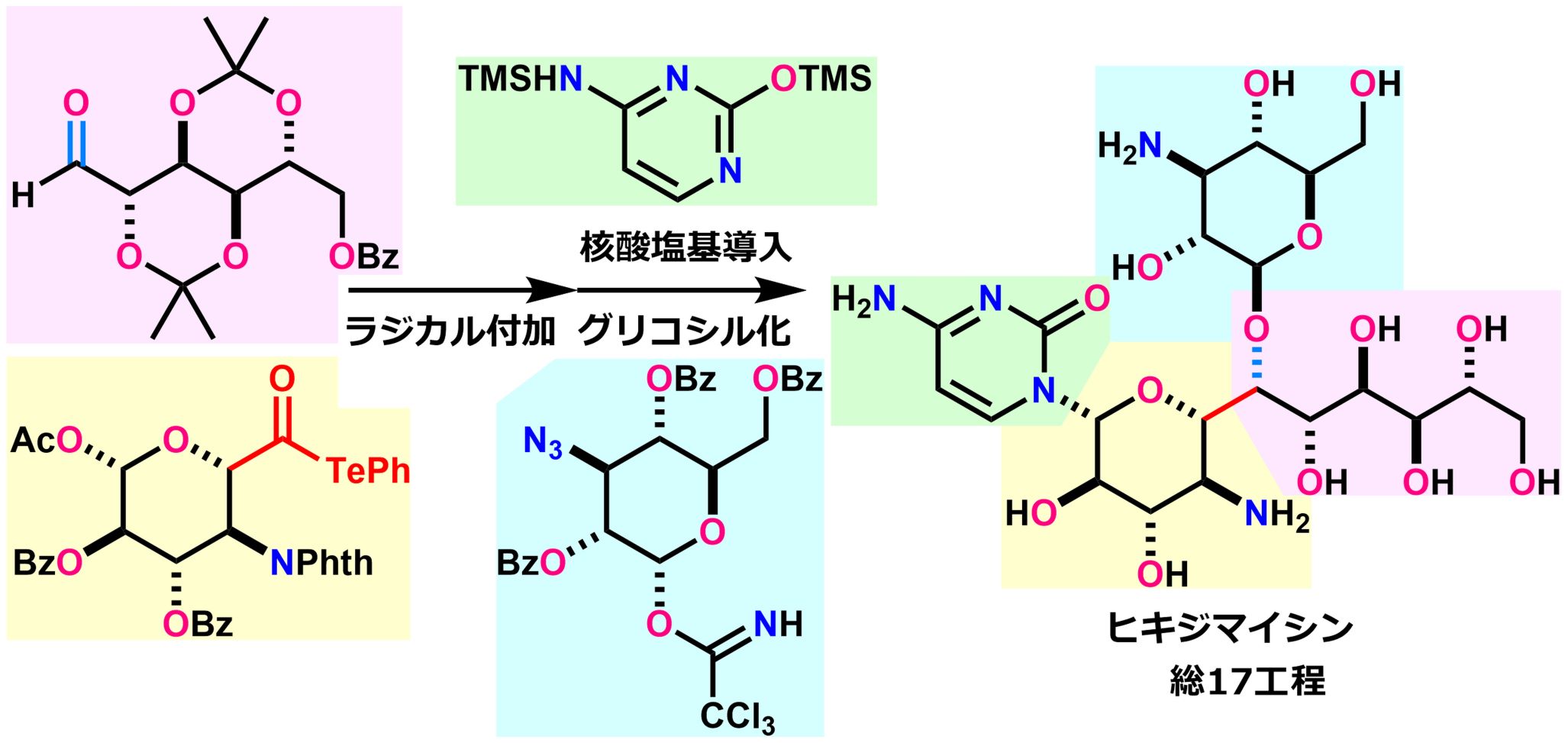
単純な2つの部分構造を連結する合成戦略により、標的分子の短工程での全合成を達成した。ラジカル反応を基盤とした合成戦略で酸化度の高い糖鎖フラグメントを連結し、標的分子の収束的な全合成を達成した。
© 2020 Haruka Fujino, Takumi Fukuda, Masanori Nagatomo, Masayuki Inoue
東京大学大学院薬学系研究科天然物合成化学教室の藤野遥博士、福田卓海大学院生、長友優典講師、井上将行教授は、核酸系抗生物質ヒキジマイシンの全合成を、ほとんど先例の無い、アルデヒドへの分子間ラジカル付加反応を鍵工程として達成しました。本研究成果は、2020年7月6日付で、化学分野の総合学術雑誌である Journal of the American Chemical Society 電子版に掲載されました。
ヒキジマイシンは、神奈川県の引地川で採取された土壌細菌から単離された抗菌・駆虫活性を示す核酸系抗生物質です。ヒキジマイシンは、全11炭素に酸素または窒素官能基が置換した直鎖構造に核酸塩基シトシンと3-デオキシ-3-アミノグルコースが縮合した他に類を見ない極めて複雑な化学構造を持ちます。
一方で、従来アルデヒドへの分子間ラジカル付加反応は逆反応が優先するために実現困難だとされてきました。井上教授の研究グループは、不安定なラジカル中間体をホウ素化合物で補足する反応条件を確立し、この反応を実現しました。
今回、本研究グループは、この独自に開発した分子間ラジカル付加反応を鍵工程として、高度に官能基化されたフラグメント同士の連結を化学・立体選択的に実現しました。その結果、余分な炭素鎖伸長や立体選択的な酸素官能基導入を回避し、標的分子ヒキジマイシンの収束的全合成を短工程で達成しました(17工程)。
本研究成果により、高度に極性官能基化された複雑分子構築におけるラジカル戦略および新規生物活性分子の創出のための収束的全合成戦略の有用性を実証しました。
「天然有機化合物(天然物)は、生命の生存競争と進化によって構造最適化された高機能分子です。生物活性天然物の化学構造は、主にsp3炭素に富んだ骨格とヒドロキシ基などに代表される極性官能基によって構成されているため、天然物の構造は3次元的に多様です。特に、炭素骨格が高度に酸素官能基化された天然物の中には、複数の水素結合を介して標的受容体を多点認識することで、強力な生物活性を発現する化合物が数多く存在します。このことからヒキジマイシンのような高酸化度天然物は化学生物学的ツールおよび創薬シード・リード化合物として期待されています」と井上教授は話します。
「本研究では、極めて困難とされてきた、ラジカルのアルデヒドに対する付加反応に挑戦し、実現しました。このフラグメントカップリングにより、収束性の最大化と官能基変換の最小化が可能になり、効率的なヒキジマイシンの全合成ルートの開発ができました。今後も、熱意ある共同研究者と共に、構造的に多様かつ複雑な天然物群の全合成に挑戦し続けていきたいと思います」と続けます。
論文情報
Haruka Fujino, Takumi Fukuda, Masanori Nagatomo, Masayuki Inoue, "Convergent Total Synthesis of Hikizimycin Enabled by Intermolecular Radical Addition to Aldehyde," Journal of the American Chemical Society: 2020年7月6日, doi:10.1021/jacs.0c06354.
論文へのリンク (掲載誌 )
)





