形を変える鍵穴 生化学の常識を覆す2種類の反応を触媒する酵素

あらゆる生き物の体内では、分解や合成などの様々な化学反応が起こっています。化学反応に使われる分子と、その反応を触媒する酵素は、鍵と鍵穴のように、互いにぴたりとはまる形をしています。そのため、一つの酵素は一つの化学反応だけを触媒するということが生化学の常識です。
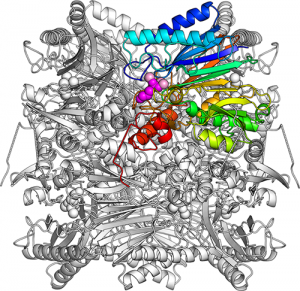
FBPアルドラーゼ/ホスファターゼの全体構造。同じサブユニットが8個寄り集まって樽のような形になる。ひとつのサブユニットを虹色(青~水色~緑~黄緑~橙~赤)で、結合した基質ジヒドロキシアセトンリン酸を紫色の球で、マグネシウムイオンをピンクの球で表した。
ところが、生命の起源に近いと考えられる超好熱性古細菌の「FBPアルドラーゼ/ホスファターゼ(FBPA/P)」という原始的な酵素は、糖を合成する一連の反応の中で、FBPアルドラーゼ反応と、FBPホスファターゼ反応という、2種類の異なる化学反応を触媒します。なぜこのようなことが可能なのか、これまで解明されていませんでした。
東京大学大学院農学生命科学研究科の若木高善教授と伏信進矢准教授、大学院理学系研究科の西増弘志特任助教らは、FBPA/Pが反応ごとに、自らの形を巧妙に変化させていることを明らかにしました。
彼らは、FBPA/PのX線結晶構造解析を行い、FBPA/Pが、それぞれの反応を触媒している途中の状態の立体構造をとらえました。その二つの構造を比較するとFBPA/Pの鍵穴部分が大きく形を変えていたのです。
通常の生物の体内では、糖の合成のそれぞれの段階で、それぞれ別の酵素が働きます。栄養となる糖が乏しい環境にいたと考えられる原始的な生命は、一人二役の酵素を利用し、今より単純な方法で炭酸ガスのような無機物からブドウ糖のような有機物の生合成を行っていたのかもしれません。今回の研究により、一つの酵素は一つの反応しか触媒しないという常識が、取り払われました。
論文情報
Shinya Fushinobu, Hiroshi Nishimasu, Daiki Hattori, Hyun-Jin Song, Takayoshi Wakagi,
“Structural basis for the bifunctionality of fructose-1,6-bisphosphate aldolase/phosphatase”
Nature 478, 538?541. doi:10.1038/nature10457
論文へのリンク