脳の特定のシナプス活動を自在に操作できることを証明! ― うつ病状態では脳を自己制御できず ―研究成果

脳の特定のシナプス活動を自在に操作できることを証明! |
平成26年4月2日
東京大学大学院薬学系研究科
1.発表者:
池谷裕二(東京大学大学院薬学系研究科 薬学専攻 教授)
2.発表のポイント:
◆ マウスが海馬の任意の神経細胞のシナプス活動を操作(自在に増加または減少)できることがわかりました(脳の自己制御)。
◆ うつ病のマウスは脳の自己制御ができない一方、抗うつ薬を投与するとシナプス活動の制御能が回復しました。
◆ 本成果は、自由意志や自発性の起源や機能に迫る可能性があり、神経活動の異常を特徴とする神経疾患の患者へ利用できる可能性が期待されます。
3.発表概要:
脳における学習は、神経細胞によって担われていることは分かっていますが、その仕組みについてはまだ多くの謎が残っています。
東京大学大学院薬学系研究科の池谷裕二教授らの研究グループは、わずか15分のトレーニングで、脳内の特定の神経細胞間の接合部位(シナプス)で起きるシナプス活動(または発火活動)パターンを、自在に活性化(または不活性化)していることを発見しました。これは、動物がシナプス単位で神経活動を自己制御できることを意味します。さらに、うつ病を示すマウスでは、学習に伴う発火活動パターンを制御できない一方、抗うつ薬を投与するとシナプス活動の制御能が回復することから、神経活動の制御にはモチベーション(やる気)が重要であることも示しました。
本成果は「自由意思」の起源や機能に洞察を与えるもので、神経活動の異常を特徴とする神経疾患の患者へ利用できる可能性が期待されます。
本成果は、2014年4月1日(米国時間)発行の米国科学誌「ジャーナル・オブ・ニューロサイエンス」に掲載されます。
4.発表内容:
<研究の背景と経緯>
脳は、多くの神経細胞(ニューロン)で構成されています。親ニューロンは、子ニューロンへ情報を伝達する際に、電気信号を出力し、子ニューロンがそれを入力として受け取ります。しかし、親からの出力を受けたとき、子は必ずしも出力できるわけではありません。子ニューロンが出力するためには一定以上の大きさの入力を受け取る必要があり、小さな入力では出力できません。そのため、複数の親ニューロンが同時に活動(同期)し、子ニューロンに大きな入力を送ることで初めて子ニューロンは出力できる仕組みとなっています。つまり、ニューロンの親子関係は1対1対応ではなく、多対多の関係です。
脳における学習とは、親ニューロンからの入力を持続的に調節することにより起こります。そのため、学習には子ニューロンへ大きな入力を送ること(強化)が重要です。子ニューロンへの入力は、「電位固定記録法」という手法でのみ観察できます。しかし、技術的な難点から、過去にほとんど行われてきませんでした。また、入力を強化するためには、時々刻々と変化する入力をリアルタイムに分析する必要があります。しかし、神経活動はミリ秒(ミリは1/1000)レベルの高速の活動であり、既存の装置では神経活動の速さに対応するほどの処理速度が得られませんでした。
<研究方法と発見の内容>
行動を伴わないニューロンの学習
従来の研究では、ニューロン活動の制御は、動物に特定の行動を示すと報酬(えさ)がもらえるよう学習させることで用いて行われてきました。しかし、このような研究手法では、学習中に動物は自由に行動できるため、ニューロンの活動の制御ではなく、単に行動(または感覚)を学習することの付随現象を観察している可能性が排除できませんでした。そこで、研究グループは特定の行動を示すマウスに報酬を与えて学習を成立させる代わりに、行動(または感覚)との関係性の低い海馬の神経活動を観察し、一定の入力が親から子ニューロンに送られた場合に、覚醒下のマウスの報酬系(注1)を電気刺激し、両者の関係性を学習させました。つまり、行動を伴わず純粋に特定のシナプス活動(入力)パターンと報酬との関係性を学習させることで、入力が強化されうるか、強化されるならどのような仕組みで強化されるのかを調べました。
神経活動の観察は、覚醒下マウスの海馬の細胞からパッチクランプ記録(注2)により行いました。パッチクランプ記録を行うことで、神経活動のうち、細胞への入力である「興奮性および抑制性のシナプス活動」、または細胞の出力である「発火活動」を観察できます。神経活動には出力につながる「発火活動」と、出力につながらない「シナプス活動」とが存在しますが、これまでは発火活動を制御した知見しかありません。実際にはニューロン内の活動の大半はシナプス活動で占められているため、シナプス活動を制御することが、神経活動を本質的に制御する上で重要です。また、神経活動と報酬刺激との関係性を学習させるためには、リアルタイムで神経活動の状態を解析する必要があります。ただし、神経活動は主に1ミリ~数百ミリ秒(ミリは1000分の1)の現象であるため、高速の計算処理が必要です。そこで、最新の装置と独自の分析プログラムを用いた、リアルタイム高速解析システムを開発しました。そして、神経活動の解析の結果がある一定の条件を満たしたときにのみ、脳の「外側視床下部」と呼ばれる報酬系に電気刺激を送ることで、報酬を与え学習を成立させました。これらにより、特定のシナプス活動の直後に報酬を与える学習が行われました。
シナプス入力またはバースト発火に対する学習
海馬での興奮性の神経活動は、持続的で大きなシナプス入力(以下、同期シナプス活動)とまばらで小さなシナプス入力の2種類に分けられます。研究グループは同期シナプス活動、およびそれに伴った連続する発火活動(バースト発火)が観察される場合に、報酬系に電気刺激を送り学習を成立させました。その結果、マウスはいずれの活動頻度も自ら増やすことができました(同期シナプス活動は図1、バースト活動は図2A, B左)。驚くべきことに、事前に何もトレーニングしていないにもかかわらず、15分以内に報酬との関係性を学習したと言えます。一方で、学習を伴わない神経活動には変化は見られませんでした(図2B右)。つまりマウスは、神経活動を全体的に高めているのではなく、学習が行われた神経活動のみを増やしていることが示唆されます。
一方で、抑制性の神経活動に対する学習では、神経活動の頻度に変化は見られませんでした。このことから、マウスは興奮性細胞の神経活動のみを制御できることが示唆されました。そこで、バースト発火に対する学習をさらに進め2つの神経細胞から同時に神経活動を記録し、任意の一方の神経細胞のバースト発火にのみ報酬系に電気刺激を送り学習を成立させました。その結果、学習を伴った細胞でのみバースト発火頻度が増えました(図2C)。逆に、バースト発火が一定期間起こらないことに対して報酬刺激を送り学習を成立させると、バースト発火は減少しました(図2D)。さらに、麻酔下でも同様の学習が可能かどうか確かめたところ、バースト発火は増えませんでした(図3A)。
バースト発火の調節メカニズム
どのようなメカニズムによってバースト発火の頻度が増えたかを調べるために、まずNMDA受容体(注3)の関与を確かめたところ、NMDA受容体の働きを阻害したマウスにおいて、報酬系に電気刺激を送る学習を行っても、バースト発火は増えませんでした。次に、ドパミンD1受容体(注4)の関与を確かめたところ、ドパミンD1受容体の働きを阻害したマウスで同様な学習を行っても、バースト発火は増えませんでした(図3B)。これらのことから、バースト発火の学習には、NMDA受容体およびドパミンD1受容体が関与することが判明しました。
ドパミンD1受容体の阻害下で学習が成立しないというデータは重要です。なぜなら、ドパミンはモチベーションに関係が深いと考えられているからです。つまり、「やる気」がニューロン活動の制御に重要であると示唆されます。この考えは麻酔下では学習しなかったという先の実験結果にも矛盾しません。
そこで、さらにこの仮説をより確かなものにするため、うつ病を示すマウスを用いて学習を行ったところ、予想通り、バースト発火は増えませんでした(図3C)。一方でこのうつ病を示すマウスに抗うつ薬を投与し同様の学習を行ったところ、バースト発火は増えました。これらのことから、マウスはバースト発火の発生には「やる気」が重要であることが明らかになりました。
本研究グループは、報酬をモチベーション(やる気)の原資にして、バースト発火やそれを引き起こすシナプス活動の発生を自在に制御できることが明らかにしました。本成果を応用することで、海馬に蓄えられた特定の記憶のみを、意図的に強めたり弱めたりすることが可能となるかもしれません。加えて本研究で用いた手法は、記憶や学習を調節する薬物を探索するための、創薬スクリーニング系としても有用な可能性を秘めています。例えば、創薬の候補となる薬物を投与したマウスに本研究で用いた学習を成立させ、ニューロンの発火頻度の変化率を調べることで、投与した薬物の記憶や学習への効果を測定できると期待されます。
<今後の展開>
神経細胞のシナプス活動を自在に増加または減少できる現象が、どのような生物学的意義をもつかを明らかにするためには、さらなる研究が必要です。認知症のように、海馬に依存した記憶に障害を示す病態では、今回のような学習を利用して正常な神経活動を増やすことが新たな治療戦略になる可能性があります。またてんかんや統合失調症、うつ病などの病態には、今回のような学習を利用して海馬で観察される異常な神経活動を減らすことが、新たな治療戦略となる可能性もあり、今後の展開が期待されます。
5.発表雑誌:
雑誌名:Journal of Neuroscience(4月1日)
論文タイトル:Operant Conditioning of Synaptic and Spiking Activity Patterns in Single Hippocampal Neurons(単一海馬ニューロンのシナプス活動およびスパイク活動パターンに対するオペラント条件づけ)
著者:Daisuke Ishikawa, Nobuyoshi Matsumoto, Tetsuya Sakaguchi, Norio Matsuki, Yuji Ikegaya*
6.問い合わせ先:
池谷 裕二(いけがや ゆうじ)
東京大学 大学院薬学系研究科 薬学専攻 薬品作用学教室 教授
8.用語解説:
(注1)動物の脳において、欲求が満たされた時または満たされることが予期されるときに活性化し、快感を感じさせる神経系。
(注2)パッチクランプ記録:先端に細孔の空いたガラス製の微細電極の先端部分を、特定の細胞の細胞膜に密着させ、電位差や伝導性などの電気的特性を調べる手法。
(注3)NMDA受容体:記憶の素過程であるシナプス可塑性に重要な、グルタミン酸受容体の一種。
(注4)ドパミンD1受容体:モチベーションが関与する学習に必須の受容体。
<本研究の主な助成事業>
最先端・次世代研究開発支援プログラム
革新的技術を用いて脳疾患を理解する「システム薬理学」の創成
研究代表:池谷裕二(東京大学大学院薬学系研究科)
科学研究費補助金
新学術領域『こころの時間学 ―現在・過去・未来の起源を求めて』
研究代表:北澤茂(大阪大学大学院生命機能研究科)
(池谷は、計画研究者として参加)
科学研究費補助金
新学術領域『メゾスコピック神経回路から探る脳の情報処理基盤』
研究代表:能瀬聡直(東京大学大学院新領域創成科学研究科)
(池谷は、連携研究者として参加)
脳科学研究戦略推進プログラム
精神疾患バイオマーカーの開発とDecNef等による臨床応用のための技術基盤整備
研究総括:川人 光男(国際電気通信基礎技術研究所脳情報通信総合研究所)
(池谷は、共同研究者として参加)
9.添付資料:
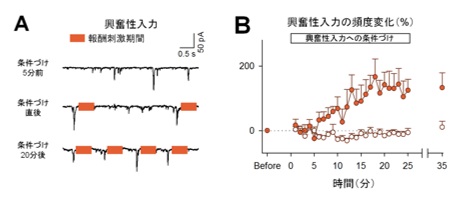
図1:マウスは、海馬の特定のニューロンに入力する同期シナプス活動を増加させられる。
(A)海馬細胞の興奮性シナプス入力の代表波形。橙色の長方形は刺激期間を表す。(B)学習を伴う同期シナプス活動は5分後から徐々に増加し15~20分後には学習前の200%近くまで達する(オレンジ色が報酬系を刺激して学習させた群)。
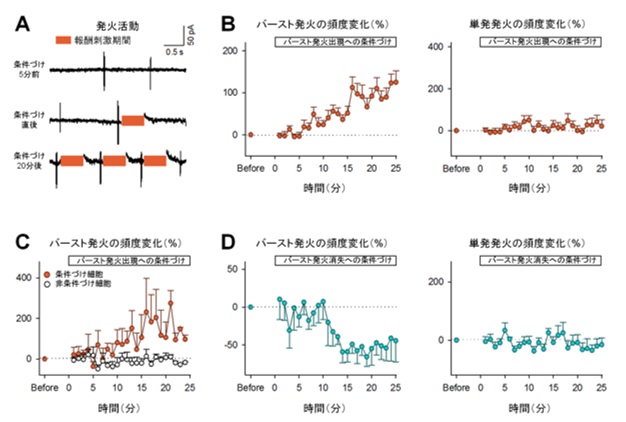
図2:マウスは、海馬の特定の神経活動(バースト発火)の頻度を選択的に増加または減少させられる。
(A)海馬細胞の発火活動の代表波形。橙色の長方形は刺激期間を表す。(B)学習を伴うバースト発火頻度は5~10分後から徐々に増加し15~20分後には学習前の150%近くまで達するが(左)、学習を伴わない場合には発火頻度は変化しない(右)。(C)学習を伴うニューロンでのみバースト発火頻度が増加する。(D)報酬刺激によってバースト発火の頻度を減少させることもできる(左)。このとき単発発火頻度は変化しない(右)。
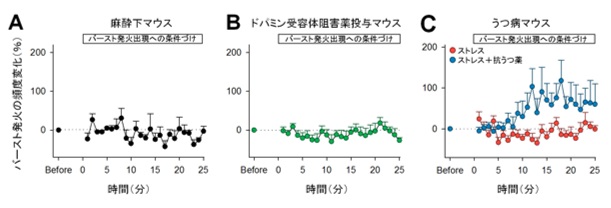
図3:マウスは、意図やモチベーションによりバースト発火頻度を増加させる。
(A)麻酔下の無意識のマウスでは、バースト発火頻度を増加しない。(B)ドパミン受容体の働きを阻害しモチベーションを低減させたマウスでは、バースト発火頻度を増加しない。(C)うつ病を示すマウスでは、バースト発火頻度を増加せず、抗うつ薬を投与したマウスでバースト発火は増えた。






