病原体の排除に関わるペントラキシン3の敗血症への効果を発見―細胞外ヒストンの血管傷害を抑制―研究成果

病原体の排除に関わるペントラキシン3の敗血症への効果を発見 |
平成26年9月17日
東京大学先端科学技術研究センター
1.発表者:
浜窪 隆雄(東京大学先端科学技術研究センター 計量生物医学、教授)
太期 健二(東京大学先端科学技術研究センター 計量生物医学、特任助教)
津本 浩平(東京大学大学院工学系研究科 バイオエンジニアリング専攻、教授)
2.発表のポイント:
細菌や真菌などの病原体を免疫細胞に食べられやすくするPTX3(注1)が細胞外ヒストン(注2)を凝集させることで、炎症反応を抑えることを発見しました。
PTX3は細胞外ヒストンによる血管内皮細胞の傷害を抑制し、敗血症を示すモデルマウスの生存率を改善することを見出しました。
ウイルスなどさまざまな病原体による重症の感染症、あるいは外傷、がんなどにより多臓器不全に至る疾病に有効な治療法となると期待されます。
3.発表概要:
重症敗血症(注3)では全身で炎症反応が起こり、複数の臓器の機能不全により死に至ることが知られています。臓器不全の原因として、通常は細胞内の核にあるヒストンが壊れた組織や炎症細胞から細胞外へ放出されること(細胞外ヒストン、注2)による傷害作用が重要であると考えられるようになってきました。しかし、その実態には不明な点が残されています。
今回、東京大学先端科学技術研究センターの浜窪隆雄教授と太期健二特任助教を中心とする研究グループは同大学大学院工学系研究科の津本浩平教授らと共同で、炎症の急性期に血中に増加するタンパク質であるペントラキシン3(PTX3、注1)の働きを調べ、PTX3がヒストンと凝集反応を起こすことを突き止めました。さらに、敗血症を発症しているモデルマウスや培養された血管内皮細胞を用いて、PTX3が細胞外ヒストンによる血管内皮細胞の傷害作用を抑制し、生存率を画期的に改善することを示しました(図1)。
本成果はPTX3の自然免疫における新規の役割の発見であるとともに、重症敗血症やその他の原因で細胞外ヒストンによりもたらされる臓器不全に対して新たな治療法を提供するものとして期待されます。
4.発表内容:
① 研究の背景
PTX3は感染症の初期に血中で上昇する急性期のタンパク質のひとつです。PTX3は白血球や血管内皮細胞に存在し、炎症部位で局所的に分泌されるため、急性期の大多数のタンパク質に比べて血中濃度が低いのがその特徴です。ウイルスや細菌、かびなどさまざまな病原体と結合し、抗原をマクロファージに渡すオプソニン化(注1)としての働きが知られており、自然免疫における可溶性のパターン認識受容体として位置づけられています。さらに、病原体排除に働いている補体系のタンパク質(注4)や細胞外基質を形成しているタンパク質との結合なども知られ、炎症反応における重要な役割が指摘されています。
一方、敗血症と呼ばれる重症の感染症では、全身における炎症反応により、複数の臓器の機能不全が起こり死に至る重症敗血症あるいは敗血症性ショックが知られ、その病態解明や治療法の開発が待たれています。近年、このような多臓器不全の病態として、壊れた組織や炎症細胞から放出される細胞外ヒストンによる内皮細胞の傷害や血小板凝集がその原因ではないかと考えられるようになってきました。従来の炎症反応では、感染が起こった病変部位で好中球や食細胞が病原菌を貪食し殺菌すると考えられてきましたが、最近では、好中球からDNAとヒストンなどの混在した好中球細胞外トラップ(NETs、注5)が投網のように放出され、病原菌をからめとるという新たな炎症反応像が提唱され注目されています。重度の感染症では、過度のNETs反応や傷害された細胞から放出される細胞外ヒストンが臓器不全の原因ではないかと考えられています。
現在までに東京大学先端科学技術研究センターの浜窪隆雄教授と太期健二特任助教を中心とする研究グループは、PTX3のみに反応する抗体を用いて敗血症患者の血液中に存在する少量のPTX3と結合するタンパク質を高感度質量分析法により調べ、PTX3の結合相手として、好中球細胞外トラップ(NETs)タンパク質と細胞外ヒストンを見出して報告しています(http://www.qbm.rcast.u-tokyo.ac.jp/topics/2012-02-14.html)。しかし、敗血症におけるPTX3の役割については、不明な点が残されていました。
② 研究の内容
本研究グループは同大学大学院工学系研究科の津本浩平教授らの協力により、PTX3と細胞外ヒストンの結合は通常のタンパク質相互作用とは異なり、タンパク質の構造が失われる凝集反応であり、すばやく不可逆的な凝集体を作る反応であることが明らかになりました。加えて研究グループは、ヒストンのH3、H4など血管内皮細胞の傷害活性や血小板凝集を起こす機能が強いヒストンとPTX3が特に強く凝集体を作ることを示しました。また、太期特任助教らは培養ヒト臍帯静脈血管内皮細胞(注6)を用いて、PTX3がヒストンによる内皮細胞の傷害を抑制することも見出しました。さらに、敗血症を示すモデルマウスにおいてもPTX3の投与により死亡率や炎症反応が劇的に改善することを明らかにしました。正常なマウスにヒストンを投与すると、肺出血を起こして死亡することが知られていますが、このようなヒストンを投与されたマウスにおいても、PTX3の投与により血管内皮細胞の傷害や肺出血が抑えられ、生存率が上昇することが分かりました。
③ 社会的意義
タンパク質の凝集反応はアルツハイマー症のβアミロイドや狂牛病のプリオンのような異常タンパク質が起こす生体にとって有害な現象が多く知られていますが、PTX3はこの性質により、細胞外ヒストンによる細胞の傷害活性をすばやく確実に中和して生体防御に役立っているものと示唆されます。
また、外傷や火傷、手術のあとなどに広範な組織の破壊が起こった場合も、同様な病態で多臓器不全が起こることが知られており、本研究による知見は感染による重症敗血症にとどまらず、さまざまな病因による臓器不全にも新たな治療法を提供するものとして期待されます。
なお、本研究は、新潟大学大学院医歯学総合研究科細胞機能講座分子細胞病理学分野内藤眞教授の研究グループおよび新潟大学医歯学総合病院病理部の大橋瑠子特任助教、順天堂大学医学部練馬病院循環器内科井上健司准教授の研究グループと共同で行われました。
5.発表雑誌:
雑誌名:「Science Signaling」(オンライン版:9月16日)
論文タイトル:Protective effect of the long pentraxin PTX3 against histone-mediated endothelial cell cytotoxicity in sepsis
著者: Kenji Daigo*, Makoto Nakakido, Riuko Ohashi, Rie Fukuda, Koichi Matsubara, Takashi Minami, Naotaka Yamaguchi, Kenji Inoue, Shuying Jiang, Makoto Naito, Kouhei Tsumoto, Takao Hamakubo*
6.問い合わせ先:
東京大学先端科学技術研究センター 計量生物医学部門
教授 浜窪 隆雄
7.用語解説:
(注1)ペントラキシン3(PTX3):炎症初期に血中に上昇する急性期のタンパク質のひとつ。ペントラキシンシグナチャーと呼ばれるアミノ酸配列をもつタンパク質の一群をペントラキシンファミリーと呼ぶ。CRP(C-reactive protein:C-リアクティブ・プロテイン)、SAP(Serum amyloid protein:血清アミロイドA)などの短いアミノ端領域を有するペントラキシンに比べ、PTX3は長いアミノ端領域を有することから長いペントラキシン(long pentraxin)と分類される。インフルエンザウイルスやアスペルギールスなどの真菌症、緑膿菌などと結合し、マクロファージなどの食細胞に取り込まれやすくする「オプソニン化」や、補体系との結合による「抗菌作用」、インターαトリプシンインヒビターやTSG6(Tumor necrosis factor-inducible gene 6)などの細胞外基質タンパク質との結合による「細胞外マトリックスの形成」などが主な働きとして知られている。このように多数の異なる分子と結合することからパターン認識受容体と呼ばれている。昆虫にも類似のペントラキシンがあり、生体防御に働いていることから、進化的に抗体分子より古い形式の防御タンパク質と考えられている。
(注2)細胞外ヒストン:「ヒストン」は通常細胞核の中にあり、DNAを巻きつけているタンパク質で、8量体を構成するコアヒストン(H2B,H2A、H3とH4)およびリンカーヒストンH1に分類される。これらのヒストンが細胞死や傷害などの原因により、細胞外に漏れ出たり、血中に放出されたものを「細胞外ヒストン」と呼ぶ。重症敗血症や臓器傷害の際には大量のヒストンが放出され、血小板凝集を促進することや、血管内皮細胞を傷害して血管透過性が増すことなどが、多臓器不全に至る原因として考えられている。
(注3)重症敗血症:細菌やウイルスなどの病原体の感染により全身の炎症が起こり、38度以上の発熱あるいは36度以下の低体温、頻脈、頻呼吸、白血球増多あるいは減少などの症状を示す病態を「敗血症」、さらに出血傾向や血圧低下、尿量減少、黄疸など臓器不全を伴うものを「重症敗血症」と呼ぶ。世界で年間1800万人が罹患し、日本では統計上年間約1万人が敗血症で亡くなっている。(詳しい診断基準は敗血症診断ガイドラインに解説されている。)
(注4)補体系のタンパク質:感染防御の働きをする一群の酵素タンパク質で、不活性前駆体として主に血中に存在し、抗原抗体複合体や微生物成分などの刺激により次々に活性化する。レクチン経路、古典経路および代替経路とよばれる3通りの活性化経路がある。食作用、溶菌作用、免疫増強作用など様々な効果をもたらす。
(注5)好中球細胞外トラップ(Neutrophil Extracellular Traps:NETs):2004年Brinkmannらによって提唱された、好中球による病原体を捕捉・殺菌する生体防御の仕組み。好中球はネトーシス(NETosis)と呼ばれる細胞死により、自身のDNAやヒストンおよび顆粒にあるミエロペルオキシダーゼなどの殺菌タンパク質を投網のように病原体に投げつける。重症感染症の際にNETsからヒストンが流出し、細胞外ヒストンの供給源になると考えられている。
(注6)培養ヒト臍帯静脈血管内皮細胞(Human Umbilical Vein Endothelial Cells; HUVEC):通常複数の臍帯静脈から単離される正常血管内皮細胞。10数回の細胞分裂までは性質がよく保たれるため、血管形成の生理学、薬理学実験等に広く用いられる。
8.添付
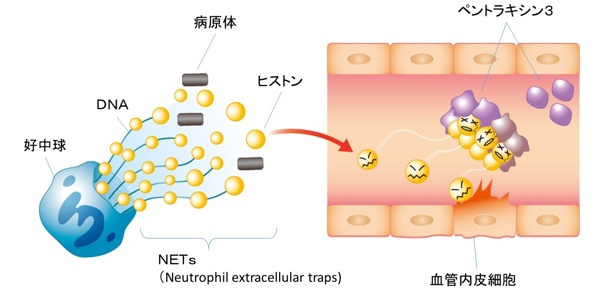
図1:細胞外ヒストンの血管傷害活性とペントラキシン3(PTX3)の保護作用
重症感染症では好中球から病原体に向けて放出される好中球細胞外トラップ(NETs)あるいは、傷害された細胞から漏出したヒストンが細胞外ヒストンとして血中に増え、血管内皮細胞を傷害し、臓器不全に至る。PTX3は、ヒストンを凝集させて内皮細胞を保護する作用がある。






