アミロイド凝集構造に含まれる疎水性ネットワークの正体研究成果
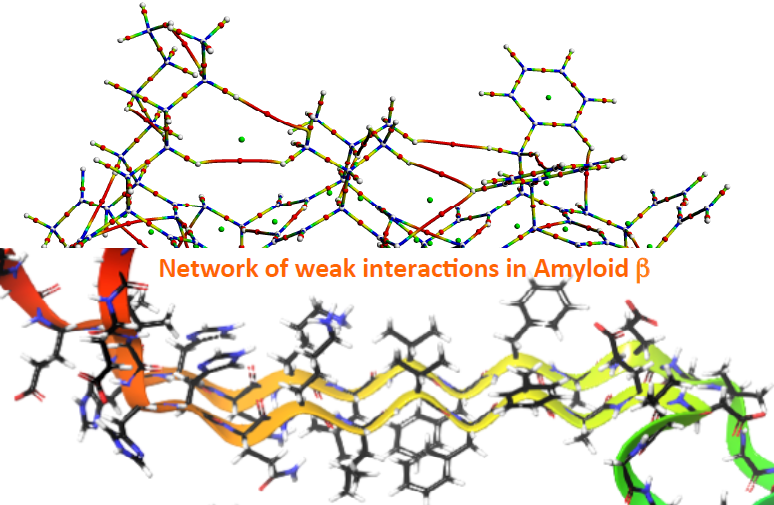
薬化学教室の翟 璐晗(ザイ ルーハン)特任研究員と大和田智彦教授らが、アルツハイマー病に関係していると考えられているアミロイドβの凝集構造の起源について計算化学を用いて解析し、今まで認識されていなかった弱い電子相互作用を疎水性領域に発見しました。
本研究成果は2019年7月24日付でScientific Reportsに掲載されました。
発表概要
詳しくはこちら
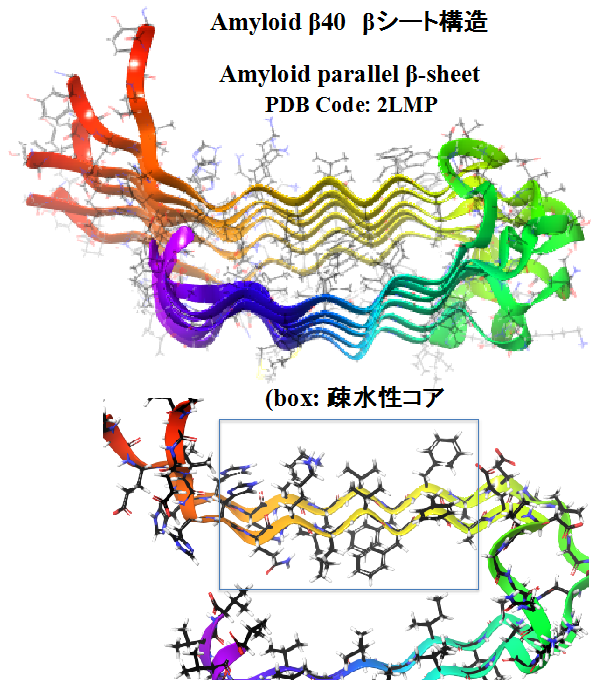
図1 (a) Amyloidβの凝集構造
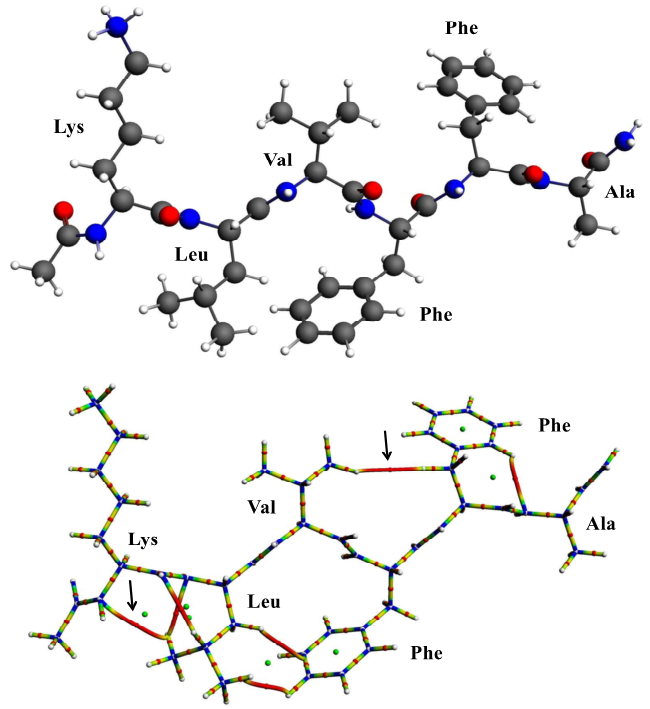
図1(b) 1本鎖(chain 1)のamyloidβの分子構造と鎖内の空間横断的なbond path(矢印)
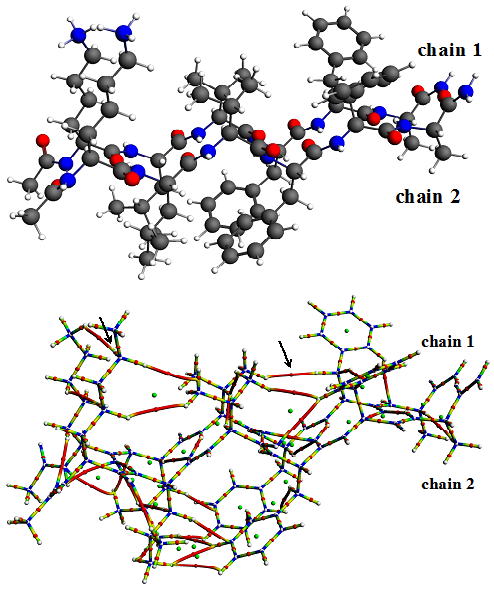
図2. Amyloidβの凝集構造の部分構造(2本鎖)の分子構造と鎖間(矢印)、鎖内の空間横断的bond pathネットワークの形成
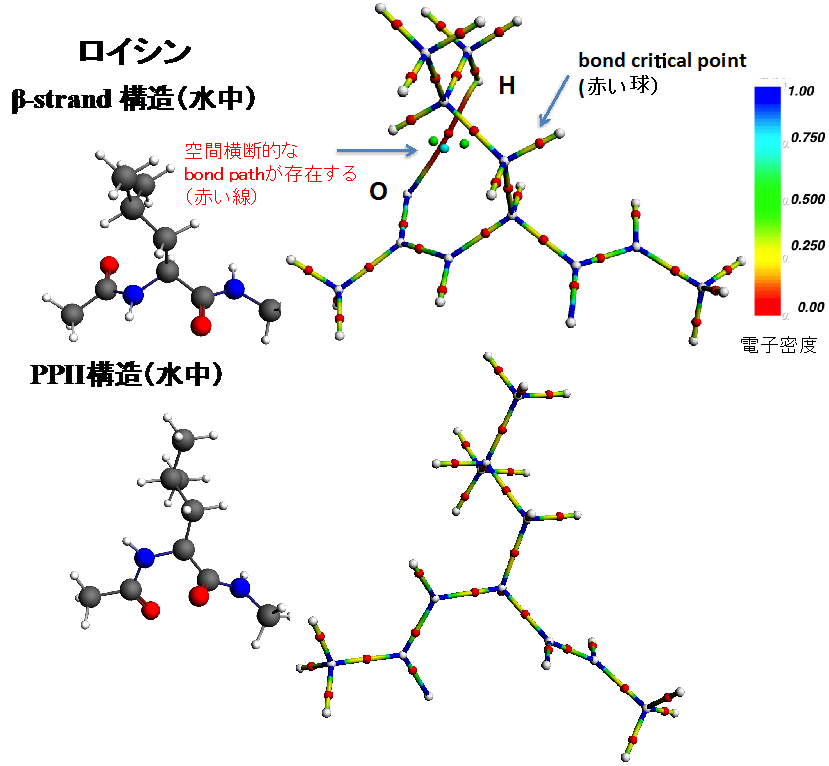
図3 β—ストランド構造を取るロイシンに見られる分子内の空間横断的なbond pathの存在: PPII構造との比較
論文情報
Luhan Zhai, Yuko Otani and Tomohiko Ohwada *, "Uncovering the Networks of Topological Neighborhoods in β-Strand and Amyloid β-Sheet Structures," Scientific Reports: 2019年7月24日, doi:10.1038/s41598-019-47151-2.
論文へのリンク (掲載誌 )
)





