細胞を殺さない基礎的なカスパーゼ活性による器官サイズの制御機構の解明研究成果
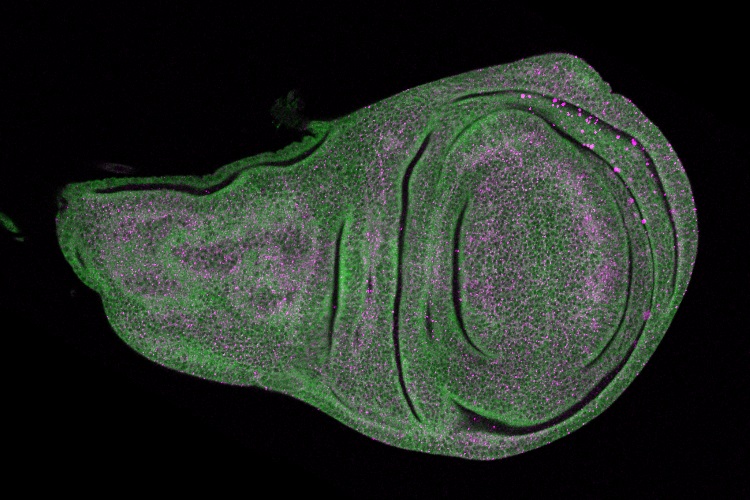
遺伝学教室の篠田夏樹特任助教、三浦正幸教授らは、ショウジョウバエの翅(はね)をモデル器官として用いた遺伝学的解析から、細胞死を実行する因子として知られるカスパーゼが細胞死実行とは別の機能(非細胞死性の機能)によって器官の成長を促進し、器官サイズの安定性に寄与することを明らかにしました。本研究成果は2019年9月24日付でProceedings of the National Academy of Sciences of the United States of Americaに掲載されました。
発表概要
詳しくはこちら
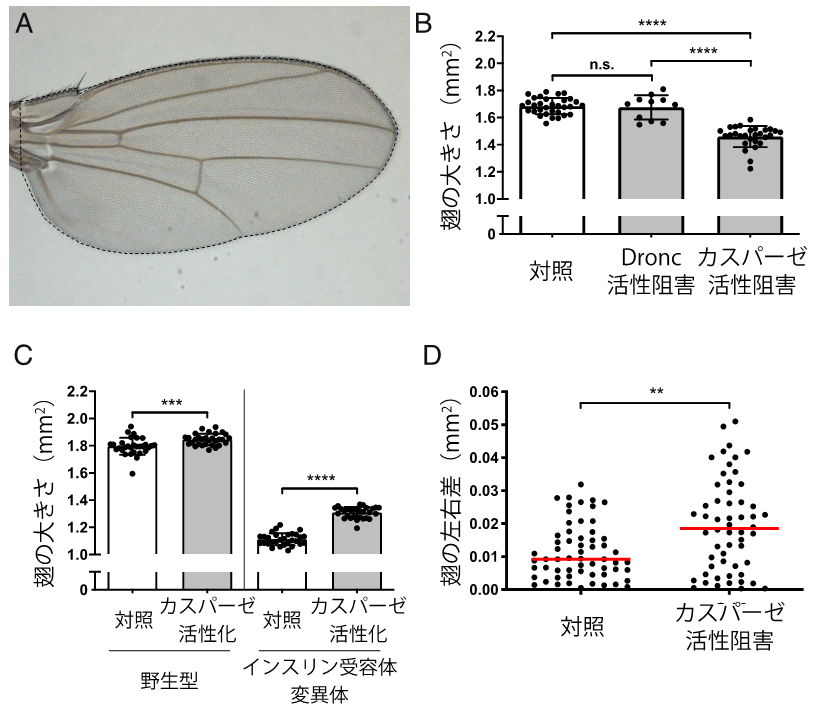
図1. カスパーゼの蛋白質分解活性がショウジョウバエの翅の成長を促進する。(A)ショウジョウバエの成虫翅の写真。破線で囲まれた領域を翅の大きさとして定量した。(B)カスパーゼの蛋白質分解活性の阻害により、翅のサイズが減少した。(C)カスパーゼの蛋白質分解活性の微弱な活性化により、翅のサイズが増大した。観察された効果は、翅が小さい変異体(インスリン受容体の変異体)でより顕著であった。(D)カスパーゼの蛋白質分解活性の阻害により、本来は左右で同じサイズであるべき翅の左右相称性が乱れた。
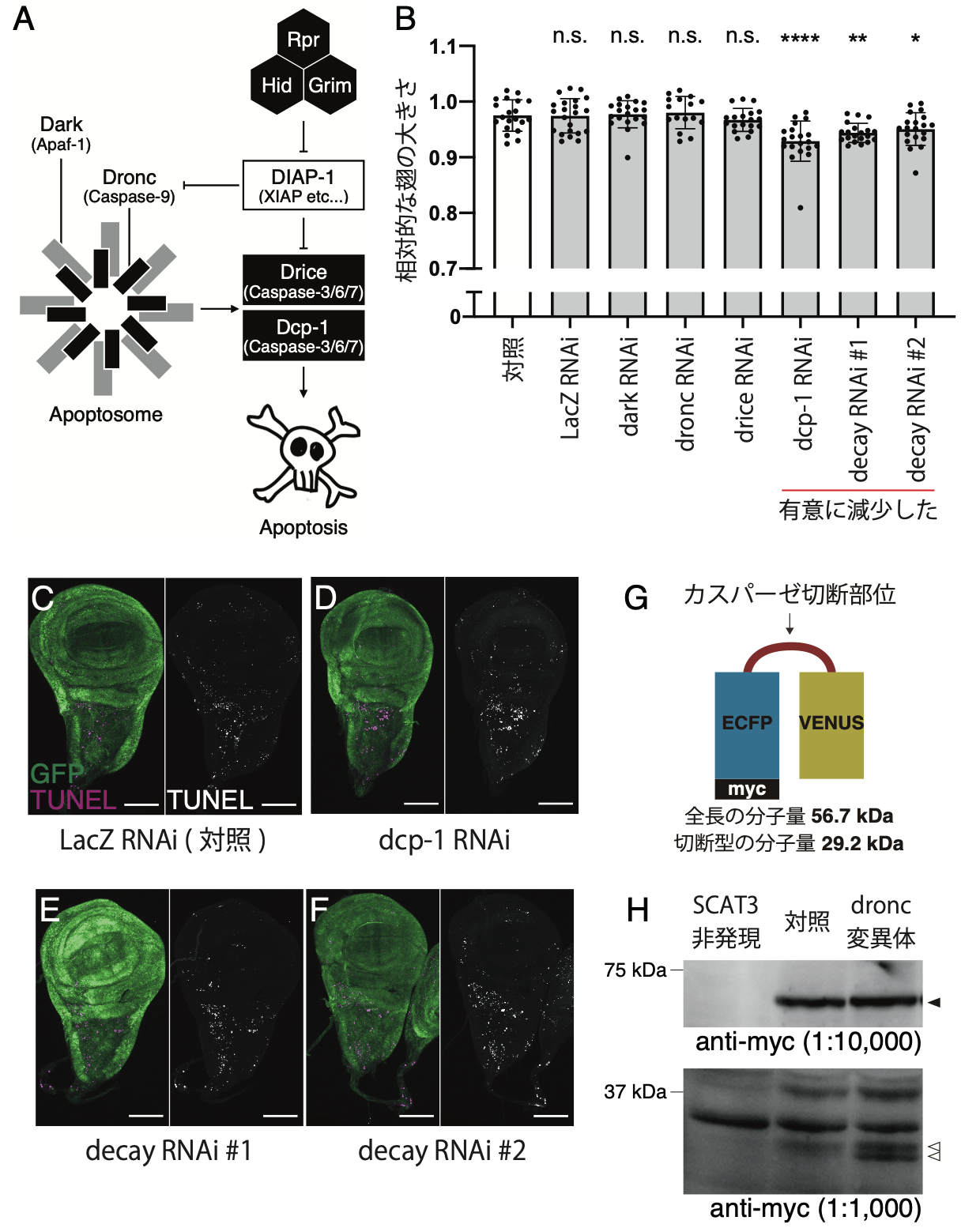
図2. Dcp-1とDecayが非細胞死性に翅の成長を促進する。(A)ショウジョウバエの細胞死経路の模式図。(B)Dcp-1とDecayのノックダウンにより、翅のサイズが減少した。(C-F)ショウジョウバエ翅成虫原基の組織染色写真。GFPで標識される細胞で遺伝子操作を行った。マゼンタはTUNEL法で検出される死細胞を示す。Dcp-1とDecayのノックダウンは、対照群と比較して翅成虫原基の細胞死には影響を及ぼさなかった。(G)カスパーゼの蛋白質分解活性を検出するプローブ(SCAT3)の模式図。(H)幼虫の全身に発現したSCAT3に対するウエスタンブロット。Dronc変異体においても、切断型SCAT3が検出された。黒矢頭:全長、白矢頭:切断型。
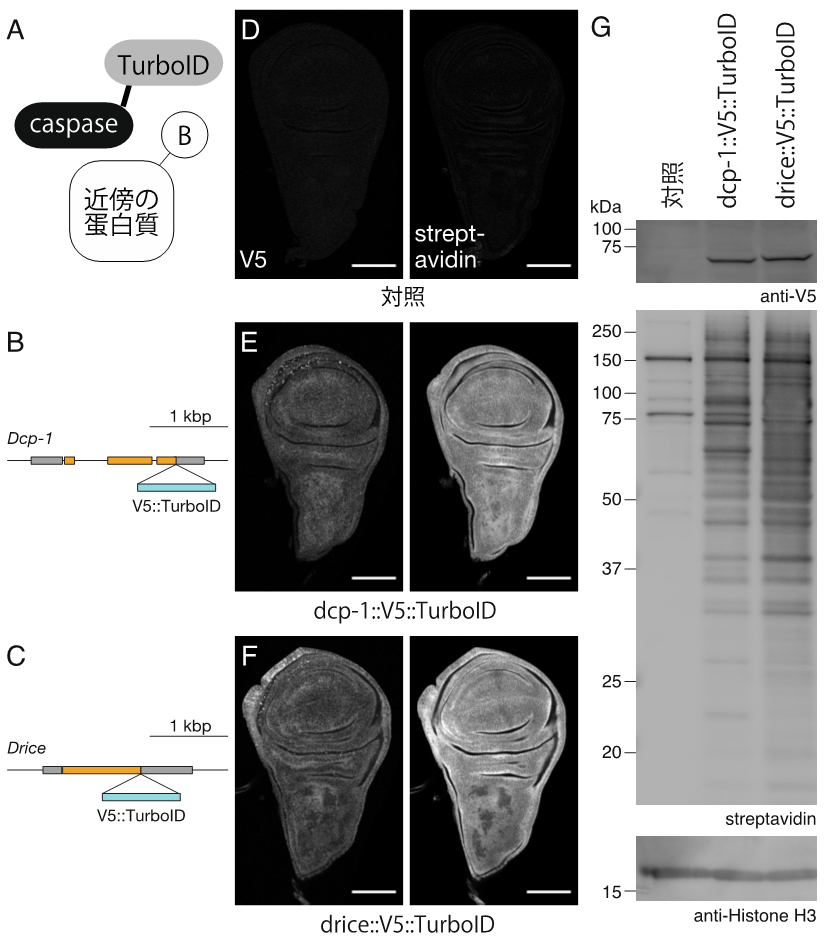
図3. 同じアミノ酸配列を特異的に切断するカスパーゼ3ホモログであるDcp-1とDriceは、近傍に存在する蛋白質に差がある。(A)TurboIDの模式図。カスパーゼ(caspase)にTurboIDを融合することで、カスパーゼの近傍に存在する蛋白質のビオチン化(B:Biotin)が可能になる。(B, C)Dcp-1とDriceの遺伝子領域の模式図。それぞれの遺伝子のC末端にTurboIDをノックインした。(D-F)ショウジョウバエ翅成虫原基の組織染色写真。Dcp-1蛋白質とDrice蛋白質は、翅成虫原基に一様に観察された。(G)翅成虫原基の蛋白質に対するウエスタンブロット。Dcp-1とDriceでは、それぞれの近傍に存在するビオチン化された蛋白質(ストレプトアビジンにより検出された)が異なっていた。
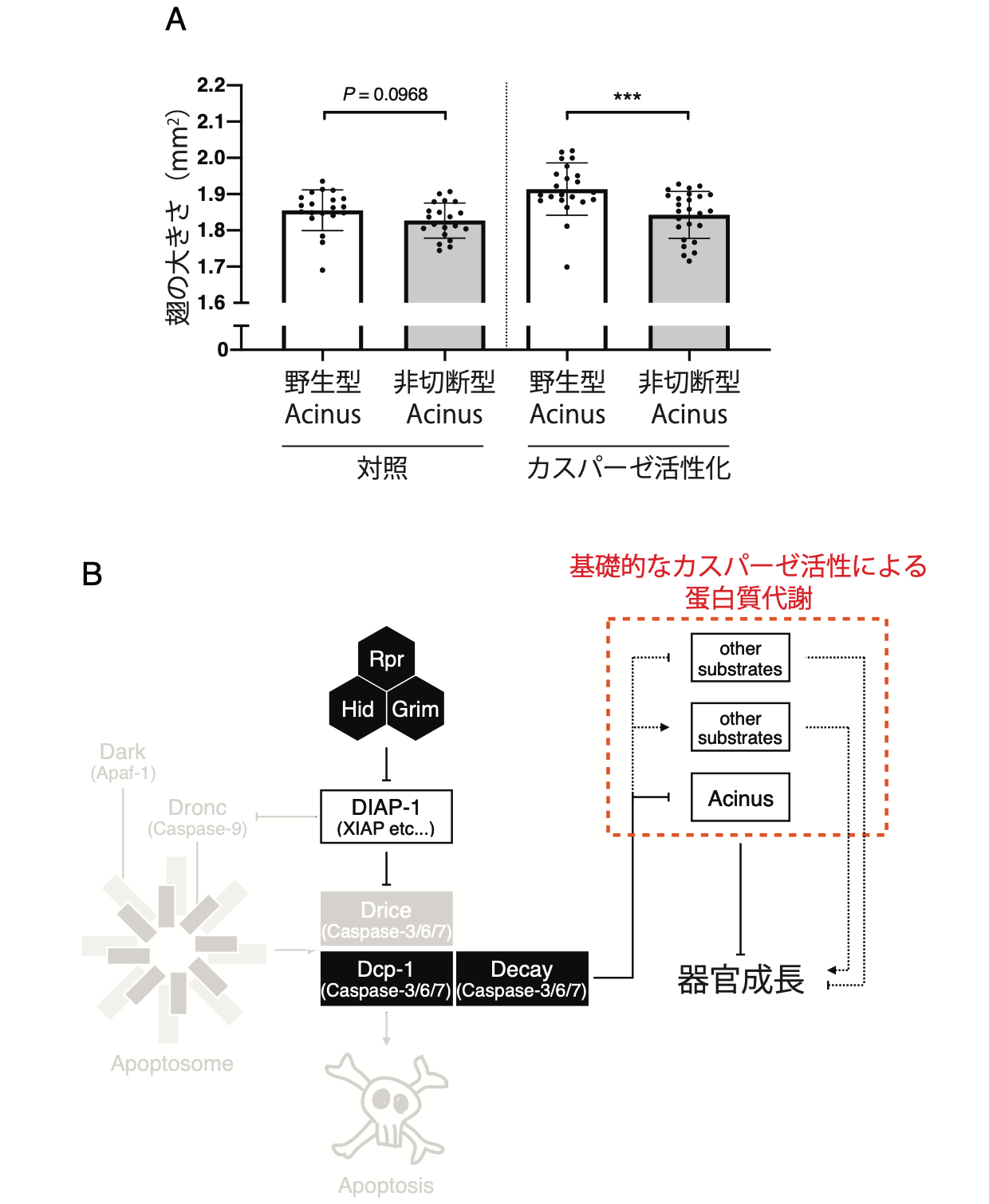
図4. 基礎的なカスパーゼの蛋白質分解活性による蛋白質代謝が、器官成長を促進する。(A)Acinusの非切断型変異体は、野生型に比較して翅サイズが小さかった。(B)本研究のまとめの模式図。健常な細胞には細胞死経路とは独立した基礎的なカスパーゼの蛋白質分解活性が存在し、Acinusを含む蛋白質の切断を介して蛋白質代謝を調節することで器官成長を促進する。
論文情報
Natsuki Shinoda, Nozomi Hanawa, Takahiro Chihara, Akiko Koto, and Masayuki Miura, "Dronc-independent basal executioner caspase activity sustains Drosophila imaginal tissue growth.," Proceedings of the National Academy of Sciences of the United States of America. (2019) in press: 2019年9月24日






