酸化的C-N結合形成を触媒するラジカル酵素反応機構の解明と酵素を利用した非天然型新規活性化合物の創出に成功研究成果
東京大学薬学系研究科の阿部郁朗教授と森貴裕助教らの研究グループは、生物活性天然物の基本骨格の構築に関わる酸化酵素の立体構造を明らかにし、酵素反応のメカニズムを解明しました。本研究成果は2019年10月21日付でNature Chemical Biology (オンライン版)に掲載されました。
発表概要
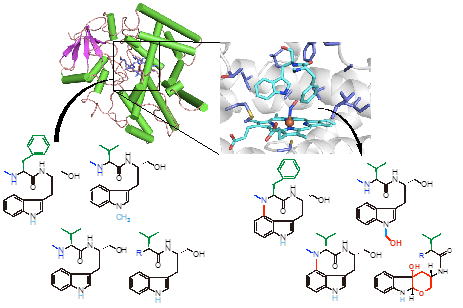
今回、研究グループはテレオシジン類の骨格形成に関わる酸化酵素を同定し、酵素に受け入れられる本来の化合物の一部分を変換した類似化合物を用いて酵素反応を行いました。その部分がどのように中心骨格の構築に重要かを確かめることで、メカニズムに対する知見を得るとともに、一連の非天然型新規化合物の創出に成功しました。さらに、酵素の立体構造を取得し、それを基に変異を導入することで酵素の活性部位に位置するアミノ酸残基の役割、重要性を明らかにしました。それらの情報を元に酸化酵素が触媒する、化合物の活性発現に必要な骨格構築の反応機構を明らかとしました。有機合成では困難な反応などに対して生体触媒によるドラッグデザインへの貢献が期待されます。
詳しくはこちら
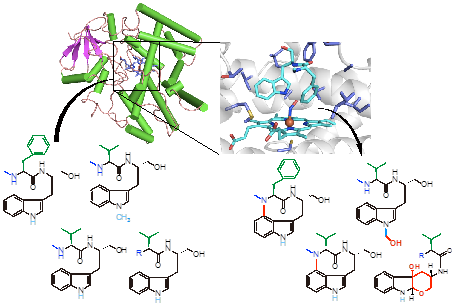
図1. インドラクタム骨格を構築する酸化酵素の反応と結晶構造
論文情報
Fei He, Takahiro Mori, Iori Morita, Hitomi Nakamura, Miroslava Alblova, Shotaro Hoshino, Takayoshi Awakawa, and Ikuro Abe*, "Dronc-independent basal executioner caspase activity sustains Drosophila imaginal tissue growth.," Molecular basis for the P450-catalyzed C–N bond formation in indolactam biosynthesis: 2019年10月21日, doi:10.1038/s41589-019-0380-9.
論文へのリンク (掲載誌 )
)





