非リボソームペプチドの環化機構を解明 ペプチド環化生体触媒の開発に期待 研究成果
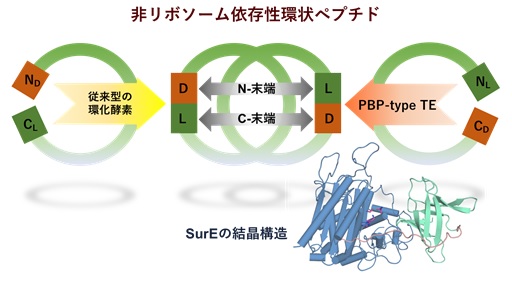
| 東京大学大学院薬学系研究科の森貴裕助教、阿部郁朗教授および北海道大学大学院薬学研究院の松田研一助教、脇本敏幸教授の研究グループは,放線菌より発見した新規ペプチド環化酵素SurEの触媒機構の解明に成功しました。ペニシリン結合タンパク質(PBP-type TE)に分類されるSurEは直鎖状のペプチド鎖の両端を認識し、N末端とC末端のアミノ酸残基間でアミド結合を形成し、環状ペプチドを効率的に合成することが分かりました。SurEはC末端残基にD-アミノ酸、N末端残基にL-アミノ酸を有する基質を選択的に受け入れ、中央部のアミノ酸残基に対しては寛容な選択性を示します。この知見はX線結晶構造解析によって得られたSurEの構造情報からも支持されました。さらにD-アミノ酸とL-アミノ酸との間のヘテロキラルな環化反応は自然界のほぼ全ての環状非リボソームペプチドにおいても共通の機構であることが分かりました。本研究ではSurEの寛容な基質特異性と放線菌細胞内で改変した非リボソームペプチド合成酵素を組み合わせることで非天然型環状ペプチドの合成にも成功しました。PBP-type TEファミリー酵素の機能をさらに開拓し、生体触媒や合成生物学的手法へ展開することによって、環状ペプチドの新しい供給法の確立につながることが期待されます。 本研究成果は、2020年5月4日公開のNature Catalysis誌にオンライン掲載されました。 |
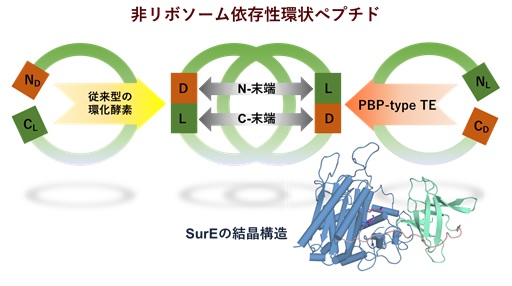
図:SurEの結晶構造と環化機構 © 2020 脇本敏幸
SurEはC末端残基にD-アミノ酸、N末端残基にL-アミノ酸を有する基質を選択的に受け入れ、中央部のアミノ酸残基に対しては寛容な選択性を示します。
論文情報
松田研一1,翟睿2,森貴裕2,小林雅和1,佐野文映1,阿部郁朗2,脇本敏幸1(1北海道大学大学院薬学研究院,2東京大学大学院薬学系研究科), "Heterochiral Coupling in Non-ribosomal Peptide Macrolactamization," Nature Catalysis: 2020年5月4日, doi:10.1038/s41929-020-0456-7.
論文へのリンク (掲載誌 )
)





