一回の反応で基質に3つの酸素原子を導入する 世界初の新奇酸素添加酵素の立体構造基盤を解明研究成果
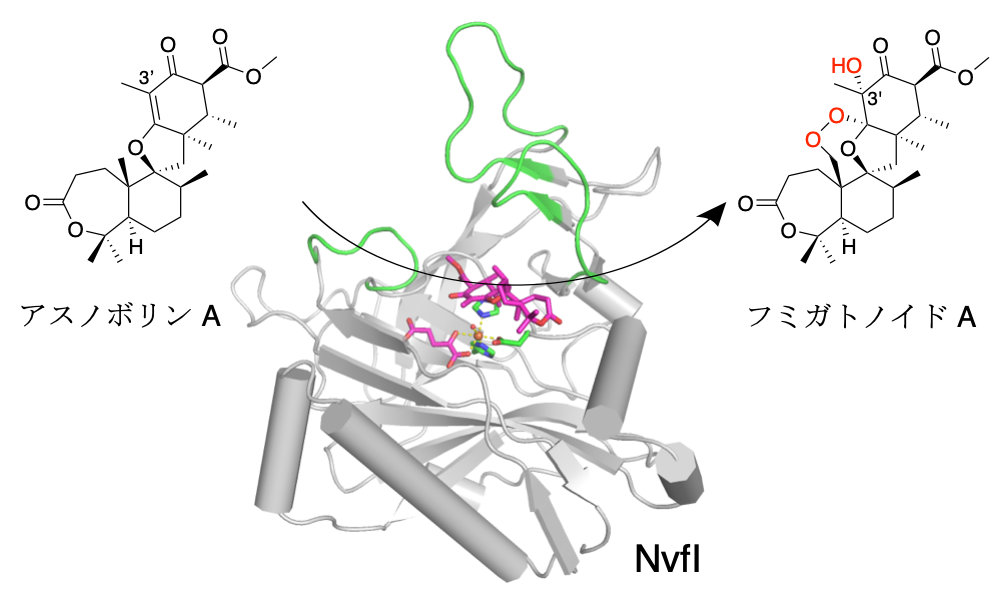
エンドペルオキシド構造は天然においても珍しい構造であり、本構造を持つ化合物群は顕著な生物活性を示すことから、重要な医薬品資源として注目されています。これまでに、エンドペルオキシド構造を形成する酵素としては2種類の酵素、ヘム鉄要求性プロスタグランジンH合成酵素(シクロオキシゲナーゼ、COX)と、Aspergillus fumigatus由来の非ヘム鉄a-ケトグルタル酸(a-KG)要求性ジオキシゲナーゼであるフミトレモルギンB 合成酵素FtmOx1が報告されていますが、これらはいずれも基質に2つの酸素原子を導入する酸素添加酵素でした。
今回、東京大学大学院薬学系研究科の森貴裕 助教、翟睿 大学院生(研究当時)、阿部郁朗 教授の研究グループは、糸状菌由来エンドペルオキシド含有天然物フミガトノイドAの生合成に関わる、一回の反応で基質に3つの酸素原子を一挙に導入してエンドペルオキシド構築と水酸化を同時に触媒する世界初の新奇非ヘム鉄酸素添加酵素NvfIについて、酵素反応の立体構造基盤を明らかとしました。安定同位体を用いた酵素反応の精密機能解析やX線結晶構造解析、さらには立体構造をもとにした部位特異的変異導入により、本酵素はこれまでに解析されているエンドペルオキシド形成酵素とは大きく異なる反応機構でエンドペルオキシド構築と水酸化を同時に触媒することを明らかにしました。自然界には依然として多くの未開拓酵素が眠っており、有機化学の常識を打ち破るような酵素反応を発掘し、その触媒原理を解明し、さらに有用化合物生産へ応用することで、薬科学の発展に貢献できます。
本研究成果は、2021年7月20日(火)公開のNature Communications誌にオンライン掲載されました。
詳細はこちら
今回、東京大学大学院薬学系研究科の森貴裕 助教、翟睿 大学院生(研究当時)、阿部郁朗 教授の研究グループは、糸状菌由来エンドペルオキシド含有天然物フミガトノイドAの生合成に関わる、一回の反応で基質に3つの酸素原子を一挙に導入してエンドペルオキシド構築と水酸化を同時に触媒する世界初の新奇非ヘム鉄酸素添加酵素NvfIについて、酵素反応の立体構造基盤を明らかとしました。安定同位体を用いた酵素反応の精密機能解析やX線結晶構造解析、さらには立体構造をもとにした部位特異的変異導入により、本酵素はこれまでに解析されているエンドペルオキシド形成酵素とは大きく異なる反応機構でエンドペルオキシド構築と水酸化を同時に触媒することを明らかにしました。自然界には依然として多くの未開拓酵素が眠っており、有機化学の常識を打ち破るような酵素反応を発掘し、その触媒原理を解明し、さらに有用化合物生産へ応用することで、薬科学の発展に貢献できます。
本研究成果は、2021年7月20日(火)公開のNature Communications誌にオンライン掲載されました。
詳細はこちら
論文情報
Takahiro Mori, Rui Zhai, Richiro Ushimaru, Yudai Matsuda, Ikuro Abe, "Molecular insights into the endoperoxide formation by Fe(II)/α-KG-dependent oxygenase NvfI," Nature Communications: 2021年7月20日, doi:10.1038/s41467-021-24685-6.
論文へのリンク (掲載誌 )
)





