細胞内の生々流転 医学の発展にも大きな期待がかかるオートファジー研究

ここ10年で論文急増の注目トピック
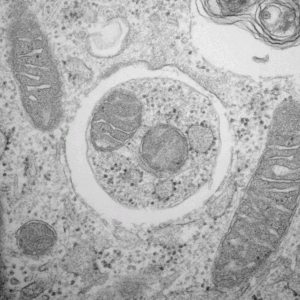
図1:オートファゴソームが細胞質成分を取り囲む様子
Adapted by permission from Macmillan Publishers Ltd: Nature Cell Biology 12(9) September 2010, copyright 2010.
写真撮影:岸千絵子
生体では細胞そのものが入れ替わる一方で細胞の中身を構成する細胞質成分も入れ替わっています。後者の仕組みのひとつがオートファジーです(図1)。あるときは状態を維持し、またあるときはダイナミックな変化を引き起こしていく生命現象のカギを握る現象として、そして生物医学研究を推し進めるエンジンとして、大変な注目を集めています。オートファゴソームという細胞小器官が細胞質成分を取り囲み、消化酵素を包んだ袋であるリソソームと融合することで分解を行うオートファジーの研究が、東京大学大学院医学系研究科の水島昇教授、東京工業大学フロンティア研究機構の大隅良典特任教授を筆頭に、世界各地で盛んに行われています。
酵母で飛躍したオートファジー研究
「物質の合成」、すなわち、「どのようにものが作られていくのか」が研究の中心だった頃、物質が合成され、分解され、そしてまた合成されるという一連の流れに興味を抱いていた水島博士の視線は新陳代謝に注がれていました。当時はしかし、新陳代謝はきちんとした学問にはなっていませんでした。その重要性にもかかわらず、研究手法がほとんどなかったのです。
転機が訪れたのは1997年、大隅教授(当時:基礎生物学研究所 教授)の論文を読んだときのことでした(図2)。酵母のオートファジーに関連する遺伝子を同定したと報告するという、どちらかというと地味な論文でしたが、実はこれこそオートファジーを学問にする嚆矢でした。顕微鏡を使った観察実験が主流だったところに、分子生物学的なアプローチの道が開かれたのです。オートファジーの研究が学問になると確信した水島博士は、すぐさま大隅教授のもとに向かうことを決めました。
大隅教授のもとで研究を進めること数年、酵母オートファジー関連遺伝子の機能が明らかになっていきました。また、それら遺伝子の多くは哺乳類や植物などに備わっていることもわかり、その後のオートファジー研究の大躍進につながりました。
哺乳類のオートファジーと医学
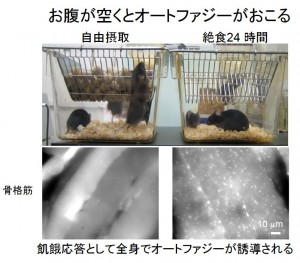
医師でもある水島教授は、研究当初から哺乳類への応用を見据えていました。しかしそこにも、研究手法が確立されていないという問題がありました。突破口となったのが、2004年の水島教授らによる2つの成果、全身のオートファゴソームが蛍光で光るマウスと、オートファジー遺伝子が働かないマウスの創出です(図3)。クラゲの遺伝子を利用してオートファゴソームを光らせてしまおうとうアイデアが、生きたまま、リアルタイムでの観察を可能にしました。これとノックアウトマウスを組み合わせることで、オートファジーの機能をつぶさに調べることができるようになったのです。
それまで酵母でわかっていたオートファジーの役割は、飢餓時の生存維持や胞子形成のために、いまある物質をリサイクルしていくという「変化・適応のためのオートファジー」であり、その機能は哺乳類の発生などでも確かに重要でした。しかし、オートファジーにはもう一つの側面「新鮮さを保つためのオートファジー」があることも水島教授は明らかにしました。これは、細胞中のゴミを掃除するというものですが、これがきちんと機能しないと、神経変性疾患になってしまいます。ということは、これを機能させるような薬ができれば、それらの病気に対処できるということでもあるのです。
さらには、がんの創薬ターゲットとしても注目されています。がん細胞のオートファジーを止めてしまうことで、がんを殺してしまおうという作戦です。人類最大の敵ともいえるがんが相手なだけにそう簡単にはいきませんが、オートファジーへの依存度が他の細胞よりも高いがんが見つかれば、それに対する特効薬が登場する可能性があります、と水島教授は力強く語ります。
共同研究への期待と展望
オートファジー研究の趨勢が、医学との連携に向かうことは間違いないことでしょう。とはいえ、基礎研究もまだまだ不足しています。特定の成分だけを分解する選択的オートファジーのメカニズムや生物学的意義、オートファゴソームの形成メカニズムなどは、まだ多くの研究課題が眠るフロンティアです。
水島教授が研究室を東京大学に移した理由もここにあります。世界中の研究室と電子的につながることが可能になったいまでも、関連する研究室とのリアルな交流からはじまる研究は数多くあります。医学部内に限らず、理、薬、農、工学部などとの共同による多角的なアプローチを水島教授は目指しています。
ヒトでの研究すらもあらかじめ視野に入れていたものの、これほどの可能性が埋もれていることまでは想定していなかった水島教授は、「私がすごいのではなく、オートファジーがすごかったのです」と謙遜して話します。しかし、そんな水島教授もまた、「変化のため」に大隅教授のもとへ、そして東京大学へと、常に移りゆくオートファジーのような存在といえます。オートファジー研究もまた、次の10年で大きく変化していくことでしょう。
取材・文:堀部直人
取材協力

水島昇教授