脳の糸くずのない未来 アルツハイマー病の予防に向けた総力戦
アルツハイマー病の発症メカニズムが明らかになるにつれて、早期治療が必要であることがわかってきました。早期治療には早期診断が不可欠です。そのためにJ-ADNIという大規模な研究プロジェクトが東京大学を中心に進んでいます。
「アルツハイマー病のない社会」を目指す
高齢化社会の到来とともに、認知症の患者数が増加しています。2020年には、患者数が325万人になると予測されており、その対策が迫られています。認知症とは、「生後いったん正常に発達した種々の認知機能が慢性的に減退・消失することで、日常生活や社会生活を営めない状態」をいい、その原因で一番多いのがアルツハイマー病です。
アルツハイマー病は、ドイツの病理学者アルツハイマー博士によって、1906年にはじめて報告された大脳が萎縮する疾患で、進行とともに記憶力や判断力に問題が生じます。そして、つい最近まで治療法も診断法もなく、予防もできない困難な病気と考えられていました。しかし、現在では発症メカニズムが明らかになってきており、治療や予防の可能性が高まっています。東京大学大学院医学系研究科の岩坪威教授は、「アルツハイマー病のない社会」を目指して、基礎と臨床の両面からアルツハイマー病に挑んでいます。
疾患の原因を解明する
「研究を始めるきっかけは、病理学の診断法を学ぶために神経病理学の研究室に通ったことです」と岩坪教授は話します。岩坪教授は、東京大学医学部を卒業後、神経内科医として脳疾患の治療にあたっていました。教授が診療を行いながら、脳研究施設脳病理学部門(現 神経病理学研究室)で研究を始めた1980年代から90年代にかけては、タンパク質や遺伝子解析の関連技術が進歩して、分子生物学が発展した頃でした。岩坪教授の指導教官である井原康夫教授(現 同志社大学教授)がアルツハイマー病に関連するタンパク質「タウ」を発見し、それまで顕微鏡で脳の萎縮などの変化としてしか捉えることができなかった病気が、分子レベルの変化として明らかになってきたのです。
「研究がどんどんおもしろくなり、薬学部のポストを得たのをきっかけに研究の道を選びました。薬学部では、臨床から離れたため、研究に専念できました。さらに、化学の教育を受けた人が集まっているので、基礎研究を進めやすかったですね」と岩坪教授は振り返ります。
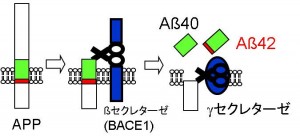
図2:アミロイドβのできる過程
前駆体タンパク質(APP)から、βセクレターゼとγセクレターゼという酵素に分解されてアミロイドβが生じる。γセクレターゼの分解する場所によってアミロイドβ40かアミロイドβ42になる。
© Takeshi Iwatsubo.
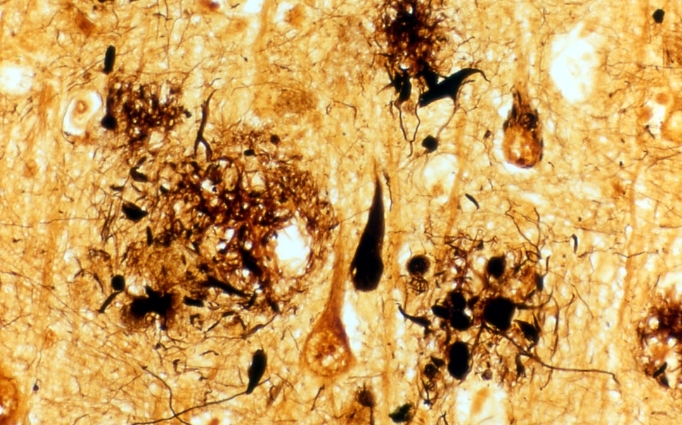
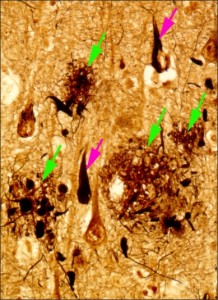
アルツハイマー病は、脳にアミロイドβというタンパク質がたまることを引き金に、タウタンパク質が糸くずのように集まり、脳の神経細胞が変性したり脱落したりして、脳が萎縮することがすでにわかっていました。遺伝子研究が進むにつれて、アミロイドβは脳にある前駆体タンパク質が、γセクレターゼという酵素で分解されてできることがわかりましたが、γセクレターゼがどんな酵素なのかは不明でした。通常多く見られるアミロイドβはアミノ酸が40個つながったものです。ところが、岩坪教授らは、患者の脳にアミノ酸が42個つながったアミロイドβ(アミロイドβ42)がたまっているのを発見しました。アミロイドβ42は脳の中で固まりやすく、タウタンパク質の蓄積を促すなど発症に重要な役割を果たしていました。
「1995年に、アルツハイマー病の一種である家族性アルツハイマー病の原因遺伝子プレセニリンが発見されました。この遺伝子がγセクレターゼと関わるのではないかと実験を進めました」。岩坪教授は、自身の研究室の2期生である富田泰輔さん(現 東大薬学部臨床薬学教室准教授)らとともに、この遺伝子の情報から合成されるプレセニリンタンパク質に異常が起こるとγセクレターゼのはたらきが変わり、正常ではできないアミロイドβ42が脳にたまってアルツハイマー病を発症することを示しました。
2000年代になると、遺伝子の解析技術がさらに進歩し、γセクレターゼの解析が進みました。そうして得られた結果から、γセクレターゼはプレセニリンタンパク質と3種類のタンパク質から成り立っていることがわかりました。まずプレセニリンに2種類のタンパク質が結合して複合体をつくり、最後にPEN-2というタンパク質が結合して、酵素の作用をするγセクレターゼができあがるのです。決まった順番でタンパク質が結合しないと、γセクレターゼは作用しないこともわかりました。こうして、アルツハイマー病の原因とされるアミロイドβをつくる酵素「γセクレターゼ」のはたらく機構を解明しました。
早期診断のための大規模な臨床研究
アルツハイマー病の発症メカニズムが明らかになると、病気の原因である脳のアミロイドβを取り除いたり、たまるのを防いだりすれば病気の治療ができるという考えが生まれ、次々と治療薬が開発されることになりました。しかし、薬の効果を試そうにも、「いつ、どれくらいアミロイドβの生成を抑えれば薬が効いたといえるのか」など、効果を判定する基準はまだありません。また、アルツハイマー病では、症状が現れるかなり前から脳にアミロイドβがたまっています。アルツハイマー病と診断された段階では、脳の変化がだいぶ進んでいるので、根本的に治療するには症状の出る前のできるだけ早い段階で治療を開始することが必要です。しかし、アルツハイマー病を早期に診断する基準も決まっていないので、いつから治療を開始すればいいかもわからない状態です。これでは、せっかく薬が開発されても先には進みません。
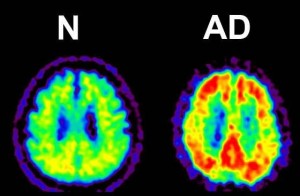
米国では、2005年からアルツハイマー病の診断と治療の基準をつくるためのADNI(Alzheimer’s Disease Neuroimaging Initiative)という大規模な臨床研究が始まりました。健康な状態から発症するまでの過程で、脳にどんな変化が起こるのかを画像診断などで厳密に調べ、病気の進行の指標となるバイオマーカーを見つけようというものです。
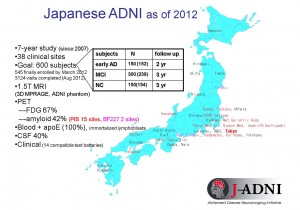
「共同研究者のペンシルバニア大学の教授にこの話を聞いたとき、日本でもすぐにこの臨床研究を始めなければと思いました。他の研究者からも始めるべきだという声が上がり、日本版のADNI(J-ADNI)の準備にとりかかったのです」。2007年に岩坪教授をプロジェクトリーダーに、全国38の施設が参加してJ-ADNIがスタートしました。
J-ADNIでは、約600人の被験者を対象に、脳の画像検査や生化学検査、心理テストなどによる2~3年の追跡調査を行っています。病気の診断基準をつくるため、米国のADNIとできるだけ同じ方法をとり、条件をそろえます。
「脳にアミロイドβがたまっている様子を生きたままで観察できるアミロイドPET(ポジトロン断層法)が日本でも実用化されました。J-ADNIには、こんな最先端の検査法も加わっています」と教授が強調します。日本発のアミロイドPETは米国のADNIの検査項目にも追加されました。こうして、J-ADNIが実施され、2013年度には第一期が終了します。アミロイドβの蓄積と認知症への進展の関係など、いくつかの知見がすでに得られており、アルツハイマー病の診断法に大きく貢献しています。
早期治療に向けて
J-ADNIの成果をもとに、本格的な臨床試験に向けた治療研究が2013年から始まっています。このプロジェクトは、ヒトにはじめて新薬を投与し、安全性を確かめたり、発症前の早い段階で薬剤を投与したりしたときの効果を見るもので、東大病院を拠点に臨床試験が行われます。「日本では、一般に薬の開発メーカーが臨床試験を行ってきましたので、今回のように医師が主導するのは初めてです。アルツハイマー病の早期治療に向けて、早急に治療や診断の体制づくりをしたいですね。また、J-ADNIもアミロイドがたまりはじめているが、症状のない極初期の“プレクリニカルAD”を対象とした第二期がはじまります」と岩坪教授は意欲を燃やしています。
「アルツハイマー病には、まだまだ不明な点がたくさんあり、基礎研究ももちろん進めています。J-ADNIの成果により基礎研究から臨床研究へと橋渡しをすることができ、研究成果を臨床に役立てたいという目標に近づいています。アルツハイマー病のない社会をつくるためには、やる気と人材が重要です。医学や薬学ばかりでなく、心理学や認知行動学などの専門家も必要です」。
米国のADNIも第2段階へ進んでおり、韓国や欧州でもADNIと同様の研究が行われています。これらの成果をもとに、アルツハイマー病の世界的な診断基準が間もなくつくられることでしょう。東京大学は、アジアのそして世界のアルツハイマー病の研究拠点として発展していくことが期待されています。



 岩坪威教授
岩坪威教授


