筋萎縮性側索硬化症に特異的病理変化の謎解明 変異AMPA受容体により活性化されたカルパインがTDP-43を切断

国際医療福祉大学臨床医学研究センター 郭伸特任教授(東京大学大学院医学系研究科 疾患生命工学センター 臨床医工学部門 客員研究員)、東京大学大学院医学系研究科 疾患生命工学センター 臨床医工学部門 山下雄也特任研究員らの研究グループは、科学技術振興機構・戦略的研究推進事業(CREST)研究において、理化学研究所 西道隆臣チームリーダーらとの共同研究で、筋萎縮性側索硬化症(ALS)の原因メカニズムを、世界に先駆けて明らかにしました。
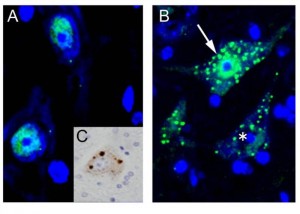
ADAR2コンディショナルノックアウトマウス(AR2)の脊髄前角運動ニューロンでのTDP-43免疫組織化学的観察 c teamkwak(A)正常マウスの運動ニューロンでは、TDP-43は、核に局在する。(B)AR2マウスの運動ニューロンでは、細胞質に封入体(inclusion)が観察され、核のTDP-43の染色性が低下(矢印)ないし消失(星印)する。TDP-43(緑)、TOPRO-3(青;細胞マーカー)。(C)ALS患者運動ニューロンのTDP-43病理。AR2 マウス運動ニューロンのTDP-43局在異常に類似している。
ALSは筋肉を動かす運動ニューロンの変性・死滅が、呼吸機能も含む進行性の筋力低下を引き起こす主に初老期以降に罹患する難病で、発症から数年のうちに死に至る病です。患者数は日本だけでも8,000人を超え、加齢と共に頻度が増し60歳以降の罹患危険率は300人に一人とも言われている、決して稀な難病ではなく、病因不明のため有効な治療法がありません。
これまでの研究で、病因に関わる遺伝子やALSに特異的に見られる分子異常は特定されてきましたが、未だその因果関係や運動ニューロン死に至るまでのメカニズムが解明されておらず、病因判明には至っていませんでした。
研究グループは、ALSの病因に関わる疾患特異的分子異常として異常なカルシウム透過性AMPA受容体が発現していることを既に発見しており、今回、この異常がカルパインの活性化を通じてもう一つの疾患特異的分子異常であるTDP-43病理を引き起こしているという分子連関を解明しました。本成果により、これまで知られていたALSの病因に関わる二つの分子異常のメカニズムと分子関連が初めてわかりました。特にこれは、ALS患者の大多数を占める、遺伝性のない孤発性ALSの病因を説明するメカニズムであり、治療へ向け一歩前進したといえます。
プレスリリース [PDF]
論文情報
Masahiro Yuki, Hiromasa Tanaka, Kouitsu Sasaki, Yoshihiro Miyake, Kazunari Yoshizawa, Yoshiaki Nishibayashi,
“Iron-Catalyzed Transformation of Molecular Dinitrogen into Silylamine under Ambient Conditions”,
Nature Communications Online Edition: 2012/12/5 (Japan time), doi: 10.1038/ncomms2264.
論文へのリンク






