より優れたアルツハイマー病治療薬の創成への第一歩 γセクレターゼ活性修飾薬の分子機構を明らかに

高齢化社会において大きな問題となっている認知症の多くを占めるアルツハイマー病は、アミロイドβタンパク質(Aβ)が脳に異常に凝集し沈着する老人斑として蓄積することを契機に発症すると考えられています。Aβの中でも特に凝集性の高いAβ42と呼ばれるタンパク質がアルツハイマー病の原因物質として注目されています。このAβを産生する酵素γセクレターゼの活性を制御し、Aβ42の産生のみを抑える化合物γセクレターゼ修飾薬は、副作用のないアルツハイマー病の治療薬として期待されていますが、その作動原理は不明でした。
© 2014 富田 泰輔
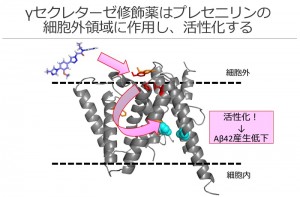
γセクレターゼ修飾薬はγセクレターゼの酵素活性を担うプレセニリンの細胞外に作用し、膜内に存在する活性中心の構造を変化させる。この構造変化により、γセクレターゼが活性化され神経細胞におけるAβ42の産生を低下させる。
今回東京大学大学院薬学系研究科の富田泰輔教授、竹尾浩史元大学院生らのグループは、フェニルイミダゾール骨格を持つγセクレターゼ修飾薬がγセクレターゼを活性化していることを新たに発見しました。また、このγセクレターゼ修飾薬はΓセクレターゼ中にあるプレセニリンの細胞外領域に結合し、γセクレターゼの活性中心となる構造に影響を与えていることも見出しました。
本成果は、フェニルイミダゾール骨格を持つγセクレターゼ修飾薬の作動原理と作用部位を、世界で初めて同定したものです。今後、新たなアルツハイマー病の治療薬を化合物の構造や機能、そして標的分子との相互作用に基づいて合理的に設計する戦略に貢献し、その開発が加速することが期待されます。
論文情報
Takeo K, Tanimura S, Shinoda T, Osawa S, Zahariev IK, Takegami N, Ishizuka-Katsura Y, Shinya N, Takagi-Niidome S, Tominaga A, et al.,
“Allosteric regulation of γ-secretase activity by a phenylimidazole-type γ-secretase modulator”,
Proceedings of the National Academy of Sciences Online Edition: 2014/7/9 (Japan time), doi: 10.1073/pnas.1402171111.
論文へのリンク






