細胞増殖、個性獲得、あるいは細胞死? 細胞運命を左右する蛋白質分解酵素の調節機構研究成果

細胞増殖、個性獲得、あるいは細胞死? 細胞運命を左右する蛋白質分解酵素の調節機構
|
1. 日 時:平成18年8月2日(水)13:00~14:00
2. 場 所:薬学系総合研究棟2階セミナー室
3. 発 表 者:大学院薬学系研究科 教授 三浦 正幸
4. 発表概要:
受精から始まる私たちの体作りは細胞増殖、細胞の個性化、そして細胞死によるダイナミックな変化を経て完成する。これらの変化は完成した体の中でも絶えず起こっていて、体を構成する細胞の多くは毎日少しずつ置き換わっている。その結果、一年前の私と今の私は一見同じように見えるが実は古くなった細胞が死んで新しい細胞に置き換わった姿を見ていることになる。私たちの体は細胞増殖、個性化、細胞死が絶妙なバランスで維持されているわけである。このバランスが崩れた場合には様々な疾患が引き起こされる。例えば増殖が亢進してしまう場合にはがんが引き起こされる一方で、アルツハイマー病、パーキンソン病、ポリグルタミン病に代表される神経変性疾患は神経細胞の変性・脱落が亢進する疾患である。
私たちの細胞は細胞増殖制御に関わる遺伝子(前がん遺伝子やがん抑制遺伝子)とともに、細胞死(アポトーシス)を実行する遺伝子カスパーゼを持つ。これまでのカスパーゼ活性化機構の研究から細胞死実行に至る分子メカニズムが明らかにされてきた。その一方で、カスパーゼ活性が細胞死のみならず、細胞の個性化や増殖にも関与することが次第に明らかにされてきたためカスパーゼはその活性化の程度や仕方によって細胞死以外の細胞運命をも制御する蛋白質分解酵素であるとの認識が広まった。しかし、このような多彩な生理機能を発揮するカスパーゼの活性化機構は明らかにされていなかった。今回、大学院薬学系研究科の倉永英里奈講師と三浦正幸教授らは、モデル動物であるショウジョウバエを用いた分子遺伝学的な研究によって、細胞運命を制御するカスパーゼ活性化調節機構を明らかにした。
5. 発表内容:
細胞死研究は、モデル動物である線虫を用いた遺伝学的な研究からブレークスルーがもたらされ、細胞死実行が細胞内の蛋白質分解酵素CED-3の活性化によってなされることが示された。CED-3相同分子がほ乳類にも存在し細胞死制御に関与することが明らかにされ(この分子ファミリーはカスパーゼと呼ばれる)、その活性化機構が精力的に研究された。我々はカスパーゼ1がほ乳類においては細胞死のみならず炎症反応といった免疫系との接点を持つことに注目し、カスパーゼがアポトーシス以外の生理機能をもつことに興味を抱いていた。実際にカスパーゼ活性が、細胞増殖、細胞の個性化といった細胞死以外の機能にも必要とされるとの知見が近年蓄積されてきたが細胞死実行に関わらないカスパーゼ活性化機構は不明であった。
本研究はモデル動物であるショウジョウバエを用いた遺伝学的な手法により、IKK-like kinase(IKKε)がカスパーゼ阻害蛋白質IAPのリン酸化を介してその分解を制御し、結果としてカスパーゼの活性化レベルを調節する機構を初めて明らかにしたものである。IKKεの過剰発現はIAPの分解を促進しカスパーゼ活性化と細胞死を誘導する。反対にIKKεの発現が抑えられるとIAPの蓄積がおこり、カスパーゼ活性が抑制される。しかし、IKKεの発現が抑えられ、IAP蓄積、カスパーゼ活性化抑制がおこってもプログラム細胞死には影響がなかったが、ショウジョウバエ末梢神経系神経前駆細胞の個性化に影響があらわれた。このことから、IKKε/IAP/カスパーゼ経路は細胞死以外の細胞運命を制御することが明らかになった。細胞死に至らないカスパーゼ活性は神経変性疾患における神経変性進行とも深くかかわっており、今回の発見により、今までアプローチが難しかった神経変性進行機序の解明やその治療に向けた研究が進展すると期待される。
さらに、本研究ではほ乳類IKKε相同分子がほ乳類IAP相同分子(XIAP)のリン酸化と不安定化をもたらすことも明らかにした。XIAPは多くのがん細胞で発現上昇が観察されており、XIAPの不活性化はある種のがん細胞に細胞死を誘導することから、IKKε/IAP/カスパーゼ経路とがん発症機構の接点にも興味がもたれる。一方、ほ乳類のIKK-like kinaseは感染刺激に応じて活性化し、NF-κBやIRFといった転写因子の活性化を介して自然免疫経路を制御する重要な分子としても知られていた。本研究結果は自然免疫系の賦活機構と細胞死シグナルの活性化の分岐点にIKK-like kinaseがあることを示唆するという点に関しても注目される。今回のIKKε/IAP/カスパーゼ経路の発見は、発生や病態における様々な細胞運命の決定を細胞死シグナル活性化制御から捉えるという新たな視点を提示するものであるといえよう。本研究成果は8月11日付けのCell誌に発表される予定である。
○論文情報
Kuranaga, E., Kanuka, H., Tonoki, A., Takemoto, K., Tomioka, T., Kobayashi, M., Hayashi, S., and Miura, M.: Drosophila IKK-related kinase regulates nonapoptotic function of caspases via degradation of IAPs. Cell in press.
6. 発表雑誌:Cell(8月11日付け、なおオンライン版で先行掲載される予定)
7. 解禁日時:8月4日午前1時(日本時間)(米国東部時間8月3日正午)
8. 問い合わせ先:東京大学大学院薬学系研究科遺伝学教室・教授 三浦 正幸
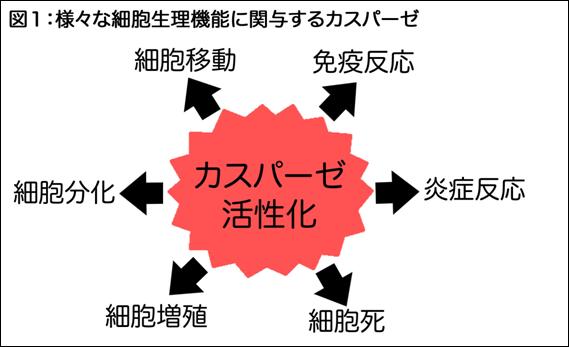
図1:細胞増殖・分化・細胞死といった様々な細胞運命決定にカスパーゼが関わっている。
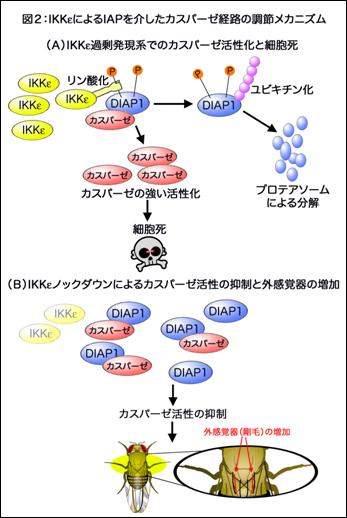
図2:IKKε過剰発現によるカスパーゼの活性化と細胞死誘(A)。IKKεの発現抑制によるカスパーゼ阻害蛋白質DIAP1の蓄積と、カスパーゼ活性の低下(B)。その結果、末梢神経系組織である外感覚器前駆細胞及び外感覚器が増加した。
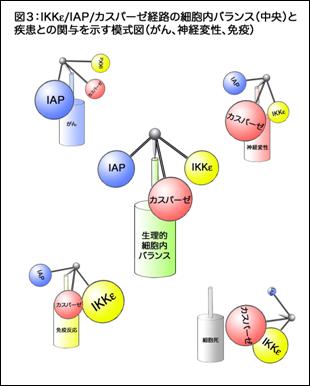
図3:IKKε/IAP/カスパーゼ経路のまとめと疾患との関わり(がん、神経変性、免疫反応)。ヤジロベエのようにIKKε/IAP/カスパーゼはバランスをとって細胞運命を決めている。カスパーゼが活性化しすぎると細胞死へむかう。しかし細胞死に至らないカスパーゼの活性化がIKKε/IAPによって制御されているときには神経変性の進行や免疫反応、がんにこの経路が関わってくると考えられる。






