ピロリ菌感染による胃がん発症の鍵となる小さなRNAの発見研究成果

ピロリ菌感染による胃がん発症の鍵となる小さなRNAの発見 |
平成26年9月4日
東京大学医科学研究所
1.発表者:
氣駕恒太朗(東京大学医科学研究所感染症国際研究センター 感染制御系 細菌学分野 特任研究員)
三室 仁美(東京大学医科学研究所感染症国際研究センター 感染制御系 細菌学分野 准教授)
笹川 千尋(千葉大学真菌医学研究センター 特任教授)
2.発表のポイント:
◆ピロリ菌への感染が原因の胃の病態形成に、小さなRNAが寄与していることを発見しました。
◆ピロリ菌の慢性感染において小さなRNAの発現が減少することで、がん遺伝子STMN1の発現が増大し、胃がんの原因となることを明らかにしました。
◆小さなRNAは、胃がんの治療や早期診断の足がかりになることが期待できます。
3.発表概要:
ヒトの胃に慢性的に定着する細菌であるヘリコバクターピロリ(ピロリ菌)は、胃に炎症を起こし、胃炎、胃潰瘍、胃がんの原因となることが知られています。これまでの臨床的な知見から、ピロリ菌と胃がん発症との関係が明らかになってはいますが、ピロリ菌の感染が、がん化に重要と考えられている異常な細胞増殖をどのように誘導するのか、その詳細な機構はほとんど分かっていませんでした。
東京大学医科学研究所の氣駕恒太朗特任研究員、三室仁美准教授と千葉大学真菌医学研究センターの笹川千尋特任教授らの研究グループは、マイクロRNA(注1)という小さな核酸物質の一種「microRNA-210」の発現が、ピロリ菌の感染した胃で顕著に抑制されていることを発見しました。これは、ピロリ菌の慢性感染によって、ゲノムDNAにメチル化修飾(注2)が起きるためであることを明らかにしました。さらに、ピロリ菌の感染によって、microRNA-210の発現が抑制されることで、STMN1(Stathmin 1)というがん遺伝子の発現が上がり、胃の細胞が異常に増殖することを示しました(図1および図2)。
胃の病態形成に関わる理解を大きく深めた本研究成果は、ピロリ菌による胃がん発症の原因解明に役立つと期待されます。
4.発表内容:
ピロリ菌はヒトの胃に定着するグラム陰性細菌で、胃炎、胃潰瘍、胃がんそしてMALTリンパ腫(注3)の形成に深く関与しています。ピロリ菌の感染によって引き起こされる胃上皮細胞の慢性炎症と増殖が、胃がん発症の主因であると考えられています。これまでの臨床的な知見から、ピロリ菌と胃がん発症との関係が明らかになっていますが、その詳細な分子機構は未だ不明な点が多く残されています。近年、マイクロRNA(miRNA)による遺伝子発現の制御が、がんを始めとするさまざまな生命現象に重要な役割を果たしていることが明らかになってきました。遺伝子発現調節におけるmiRNAの機能の重要性を考えると、胃粘膜上皮細胞へのピロリ菌の感染の際に認められるがん関連遺伝子の複雑な応答にもmiRNAが深く関与していることが推測されました。そこで東京大学医科学研究所の氣駕恒太朗特任研究員、三室仁美准教授と千葉大学真菌医学研究センターの笹川千尋特任教授らの研究グループは、胃がんの発症に深く関与しているピロリ菌の感染現象に着目し、その過程で重要な役割を果たすmiRNAを同定し、その機能を解明しました。
スナネズミにピロリ菌を経口感染させ、約2ヶ月後の胃上皮細胞を回収し、miRNAの発現を網羅的に調べたところ、microRNA-210(miR-210)の発現が顕著に減少していることを確認しました。この現象は、ピロリ菌慢性感染者のヒト胃上皮細胞においても観察されました。さらには、miR-210の発現は、胃粘膜萎縮や好中球浸潤等の病態悪性度が高いほど減少していることがわかりました。さらに研究グループは、miR-210がCpGアイランド(注4)と称される、DNAがメチル化を受け易いゲノムDNA領域にコードされており、ピロリ菌感染に起因して本領域のDNAがメチル化されることが、miR-210の発現減少を引き起こすことを見出しました。
次に、miR-210の機能を調べました。miR-210を胃上皮由来の細胞株に発現させると、細胞の増殖抑制が認められた一方で、miR-210の発現を抑制した細胞では増殖が促進されました。哺乳動物におけるmiRNAは、標的遺伝子のメッセンジャーRNA(mRNA)の3末端に位置する非翻訳領域に直接結合することにより、標的遺伝子のmRNAの発現量を抑制することが知られています。miR-210の標的遺伝子を予測するために、胃上皮細胞株にmiR-210を強制的に発現させて、発現が減少する遺伝子をマイクロアレイにより網羅的に調べたところ、28の遺伝子を見出しました。このうち12の遺伝子が、miR-210の標的配列を3’末端に位置する非翻訳領域に保有していることが確認されました。さらに、これら遺伝子の発現を抑える実験により、細胞増殖における影響を調べた結果、胃上皮細胞の細胞増殖を制御する遺伝子が、STMN1(Stathmin1)とDIMT1(DIM1 dimethyladenosine transferase 1)であることを明らかにしました。この2つの遺伝子は、miR-210によって直接的に制御されていることを別の実験により確認しました。これらの結果から、miR-210はSTMN1とDIMT1を直接的に標的とし、胃上皮細胞の増殖を抑制していることが明らかになりました。さらに、miR-210の発現が低下しているピロリ菌感染患者の胃上皮では、非感染患者の胃上皮よりも、STMN1およびDIMT1の発現量が増加していることがわかりました。STMN1は胃がんを始めとするさまざまながん細胞で発現が上昇し、腫瘍形成の早期に重要であると考えられている遺伝子であることから、ピロリ菌の慢性感染によるmiR-210の発現減少は、STMN1等を介した腫瘍形成に重要である可能性が示唆されました(図1および図2)。
本研究グループは、ピロリ菌の感染に応答するmiRNAとして、miR-210を同定しました。また、miR-210がSTMN1とDIMT1を直接的な標的とし、細胞の増殖を制御していることを網羅的な方法を用いて示すことに成功しました。ピロリ菌の慢性感染によるmiR-210の発現抑制が、胃上皮細胞の異常増殖とともにがん細胞の増殖を育む環境を作る可能性が示唆されました。さらに、STMN1と同様の胃上皮増殖作用を持つDIMT1の発現も、ピロリ菌慢性感染患者で上昇していたことは、DIMT1が新たながん遺伝子である可能性を示唆しています。胃病態形成の理解を大きく深めた本研究成果は、ピロリ菌による炎症誘発機構や、胃がん発症の原因解明に役立つことが大いに期待されます。今後は、ピロリ菌がどのようにしてmiR-210の発現を調節しているのか、より精細な解析をすると共に、miR-210やSTMN1、DIMT1を利用した胃がん検査や治療へ貢献することを目指します。
5.発表雑誌:
雑誌名:「Nature Communications」(2014年 9月4日)
論文タイトル:
Epigenetic silencing of miR-210 increases the proliferation of gastric epithelium during chronic Helicobacter pylori infection
著者:
Kotaro Kiga, Hitomi Mimuro, Masato Suzuki, Aya Shinozaki-Ushiku, Taira Kobayashi, Takahito Sanada, Minsoo Kim, Michinaga Ogawa, Yuka W. Iwasaki, Hiroyuki Kayo, Yoko Fukuda-Yuzawa, Masakazu Yashiro, Masashi Fukayama, Taro Fukao*, and Chihiro Sasakawa*
DOI番号: 10.1038/ncomms5497
アブストラクトURL:http://www.nature.com/ncomms/2014/140904/ncomms5497/abs/ncomms5497.html
6.問い合わせ先:
東京大学医科学研究所 感染症国際研究センター 感染制御系 細菌学分野
特任研究員 氣駕恒太朗(きが こうたろう)
准教授 三室仁美(みむろ ひとみ)
7.用語解説:
(注1)マイクロRNA:22塩基ほどの小さなRNAであり、植物や動物、ウイルスなど多様な生物種が保有していることが知られています。標的となるメッセンジャーRNAに結合して、タンパク質への翻訳の阻害や、メッセンジャーRNAの分解を誘導して、標的遺伝子の発現を抑制します。
(注2)DNAにメチル化修飾:DNAの中のCpGアイランド配列などのシトシンもしくはアデニンにメチル基が付加される化学反応です。DNAのメチル化の有無により、遺伝子の発現量が調節され、発生、記憶、がんの発達や悪性化に関与していることが知られています。
(注3)MALTリンパ腫:Mucosa-Associated Lymphoid Tissueという、粘膜とリンパ球の複合組織から発生するB細胞性リンパ性腫瘍。胃のMALTリンパ腫の約90%にピロリ菌の感染が確認されることが報告されています。
(注4)CpGアイランド:シトシンとグアニンの連続した配列が高頻度で確認されるゲノム領域。遺伝子のプロモーター領域にしばしば観察され、シトシンの5’がメチル化されると転写が不活化されることが知られています。
8.添付資料:
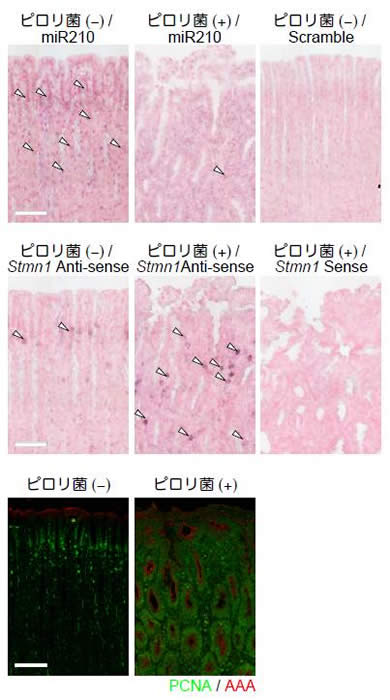
図1:ピロリ菌に感染させたスナネズミ胃粘膜のmiR-210およびSTMN1の発現。ピロリ菌が感染すると、miR-210の発現が低下し、STMN1の発現が上昇した。さらに、異常な細胞増殖が誘導されていることが、下段の染色により判明した。
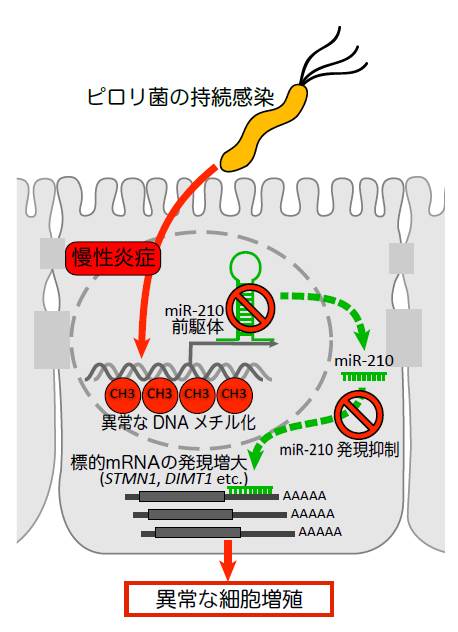
図2:ピロリ菌の感染によって、miR-210の発現が減少し、それによって異常な細胞増殖が引き起こされる過程を模式的に表した図






