最悪性脳腫瘍細胞が腫瘍をつくる仕組みを解明研究成果

最悪性脳腫瘍細胞が腫瘍をつくる仕組みを解明 |
平成26年10月3日
東京大学分子細胞生物学研究所
1.発表者: 秋山 徹(東京大学分子細胞生物学研究所 教授)
高井 弘基(東京大学大学院農学生命科学研究科 博士課程3年)
2.発表のポイント:
◆最悪性脳腫瘍「グリオブラストーマ(注1)」のDNAには、「5hmC(注2)」と呼ばれる目印が多く存在することを発見しました。
◆5hmCが、脳腫瘍細胞が腫瘍をつくるために必須であることを明らかにしました。
◆本成果は、5hmCおよび5hmCをつくる仕組みを標的とした抗がん剤の開発や、最悪性脳腫瘍の治療に貢献すると期待されます。
3.発表概要:
生命が維持されるために必要な情報は、細胞の中に収まっている「DNA」に書き込まれています。また、ほとんどのがん細胞においては、このDNAに異常がみられ、このことが細胞をがん化させる主な要因と考えられています。また、近年の研究により、がん細胞の集まりである腫瘍をつくる細胞は一様でなく、一部の「がん幹細胞」と呼ばれる細胞が腫瘍を形成する強い能力(造腫瘍能)を持っていることがわかってきました。
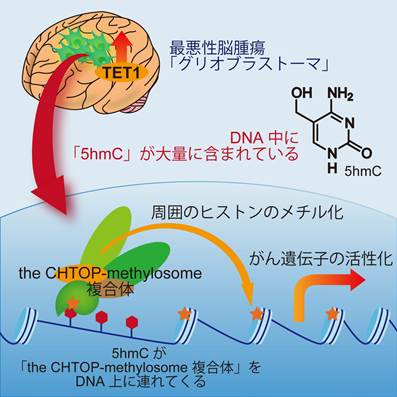
今回、東京大学分子細胞生物学研究所の秋山徹教授、同大学院農学生命科学研究科博士課程3年の高井弘基大学院生らは、同医学部附属病院の脳神経外科より提供された最悪性脳腫瘍「グリオブラストーマ」の検体を、がん幹細胞を維持した状態で培養し、そのDNAを解析しました。その結果、1)脳腫瘍のDNAには、「5hmC」と呼ばれる目印が多く存在すること、2)5hmCが、脳腫瘍が腫瘍をつくるために必須であることを世界で初めて発見しました。さらに、5hmCが大きなタンパク質「CHTOP-methylosome複合体」をDNAへと導くことで、細胞をがん化させる遺伝子を活性化していることを明らかにしました。
これらの結果は、5hmCや、5hmCをつくる仕組み、あるいはCHTOP-methylosome複合体が、脳腫瘍を治療する上で重要な標的となることを示唆しています。本成果により、今後この仕組みを標的とした薬剤が開発され、脳腫瘍の治療に貢献することが期待されます。
4.発表内容:
私たちは、約60兆個もの細胞で構成されています。ひとつひとつの細胞には核があり、さらにその中には、生命が維持されるために必要な情報が書き込まれた「DNA」が収まっています。DNAはA、T、G、Cの4種類の塩基配列からなる生命の設計図です。この設計図に異常が起きると、生命を維持することができなくなります。実際に、ほとんど全てのがん細胞においては、このDNAに異常がみられ、このことが細胞の機能を破たんさせ、がん化させる原因と考えられています。
腫瘍は、多くのがん細胞の集まりです。近年の研究によって、がんを構成しているがん細胞は全く同じものではなく、少数の細胞が特に強い造腫瘍能をもっていることがわかってきました。このような細胞を「がん幹細胞」と呼びます。化学療法や放射線治療によって一時的にがんが小さくなってもまた再発してしまうのは、大部分のがん細胞を殺すことができても、少数のがん幹細胞が生き残ってしまうためだと考えらえています。したがって、がん細胞、特にがん幹細胞のDNAがどのような異常を起こしているかを明らかにすることは、がん研究の最も重要な課題の1つです。
今回、東京大学分子細胞生物学研究所の秋山徹教授、同大学院農学生命科学研究科博士課程3年の高井弘基大学院生らの研究グループは、同医学部附属病院の脳神経外科と連携し、最悪性の脳腫瘍「グリオブラストーマ」のがん幹細胞を維持した状態で実験室内で増殖させ、そのDNAを解析しました。その結果、(1)脳腫瘍のDNAには、「5hmC」と呼ばれる目印が多く存在すること、(2)5hmCが、脳腫瘍が腫瘍をつくるために必須であることを世界で初めて発見しました。さらに、5hmCが大きなタンパク質「CHTOP-methylosome複合体」を引き付けることで、細胞をがん化させる遺伝子を活性化していることを明らかにしました。
研究グループはまず、脳腫瘍細胞のDNAを精製し、その中に含まれる5hmCの量を測定しました。すると、正常な細胞の約2~100倍にも及ぶ大量の5hmCが存在することが判明しました。5hmCはTETとよばれる酵素によって細胞の中でつくられるDNAの構成要素ですが、脳腫瘍においては、このTETのうち、TET1が特に多く存在することがわかりました。脳腫瘍細胞においてTET1の機能を実験的に抑制すると、がん細胞の増殖が顕著に抑制されることがわかりました。また、脳腫瘍細胞をマウスの脳内に移植すると腫瘍が形成されますが、このとき、あらかじめTET1の機能を抑制しておくと、腫瘍が全く形成されないことが判明しました。よって、TET1及び5hmCが、脳腫瘍が腫瘍をつくるために必須であることが示唆されました。
では、5hmCはどのような仕組みで脳腫瘍をつくるのでしょうか?今回研究グループは、5hmCを含んだDNAを人工的に合成し、それに結合するタンパク質を探しました。その結果、5hmCには「CHTOP-methylosome」と呼ばれる大きなタンパク質の複合体が結合していることがわかりました。また、5hmCはDNAの中でも、造腫瘍性に重要な役割を果たす遺伝子上に多く存在しており、「CHTOP-methylosome」はそれらの遺伝子の周囲に存在するヒストン(注3)をメチル化(注4)することで、がん遺伝子を活性化していることを見出しました。
これらの結果は、脳腫瘍細胞においてTET1、5hmCを蓄積させる仕組みや、CHTOP-methylosomeによるがん遺伝子活性化の仕組みが、脳腫瘍に対する分子標的薬を創製する上で非常に有望な標的となることを示唆しています。特に、TET1を完全に失ったマウスが正常に生育することから、TET1の機能を抑制するような薬剤が開発されれば、副作用の少ない薬となることが期待されます。本成果によって、今後これらの仕組みを標的とした薬剤が開発され、最悪性脳腫瘍の治療に貢献することが期待されます。
5.発表雑誌:
雑誌名:「Cell Reports」(オンライン版:10月2日)
論文タイトル:5-hydroxymethylcytosine plays a critical role in glioblastomagenesis by recruiting the CHTOP-methylosome complex
著者:Hiroki Takai, Koji Masuda, Tomohiro Sato, Yuriko Sakaguchi, Takeo Suzuki, Tsutomu Suzuki, Ryo Koyama-Nasu, Yukiko Nasu-Nishimura, Yuki Katou, Haruo Ogawa, Yasuyuki Morishita, Hiroko Kozuka-Hata, Masaaki Oyama, Tomoki Todo, Yasushi Ino, Akitake Mukasa, Nobuhito Saito, Chikashi Toyoshima, Katsuhiko Shirahige and Tetsu Akiyama* (*Corresponding author)
DOI番号:10.1016/j.celrep.2014.08.071
6.問い合わせ先: 東京大学分子細胞生物学研究所 分子情報研究分野 教授
秋山 徹(あきやま てつ)
7.用語解説:
(注1)最悪性脳腫瘍「グリオブラストーマ」
脳の機能的部位に生じる腫瘍のうち約52%を占め、「膠芽腫(こうがしゅ)」とも呼ばれる。予後が悪く、一年後生存率は約50%程度に留まり、五年後生存率は7.8%と非常に低い。WHOによる脳腫瘍の分類では、最悪性とされるgrade IVに分類されている。
(注2)5hmC
5-hydroxymethylcytosineの略。DNAを構成する塩基(A:アデニン、T:チミン、G:グアニン、C:シトシン)のうち、シトシンがTETと呼ばれる酵素によって酸化されたもの。
(注3)ヒストン
DNAは細胞の核内において、ヒストンと呼ばれるタンパク質に巻き付くことでコンパクトに収納されている。また、ヒストンはさまざまな因子によってメチル化・アセチル化などの化学的な目印をつけられ、それが遺伝子の発現に重要な役割を果たすことが知られている。
(注4)メチル化
ヒストンをはじめとするタンパク質が受ける化学的な目印のひとつ。
8.添付資料:最悪性脳腫瘍が腫瘍をつくる仕組み
最悪性脳腫瘍「グリオブラストーマ」においては、TET1と呼ばれる酵素が多く存在し、この酵素の作用によって、DNAの中に5hmCが大量につくられている。5hmCは、「CHTOP-methylosome複合体」をDNAの上に導き、この複合体が周辺に存在するヒストンのメチル化を介し、がん化に重要な遺伝子群を活性化することで、脳腫瘍の発生に重要な役割を果たしている。