細胞内の骨格である微小管の伸び縮みを制御する機構 脳神経回路網の形成の理解が深まる

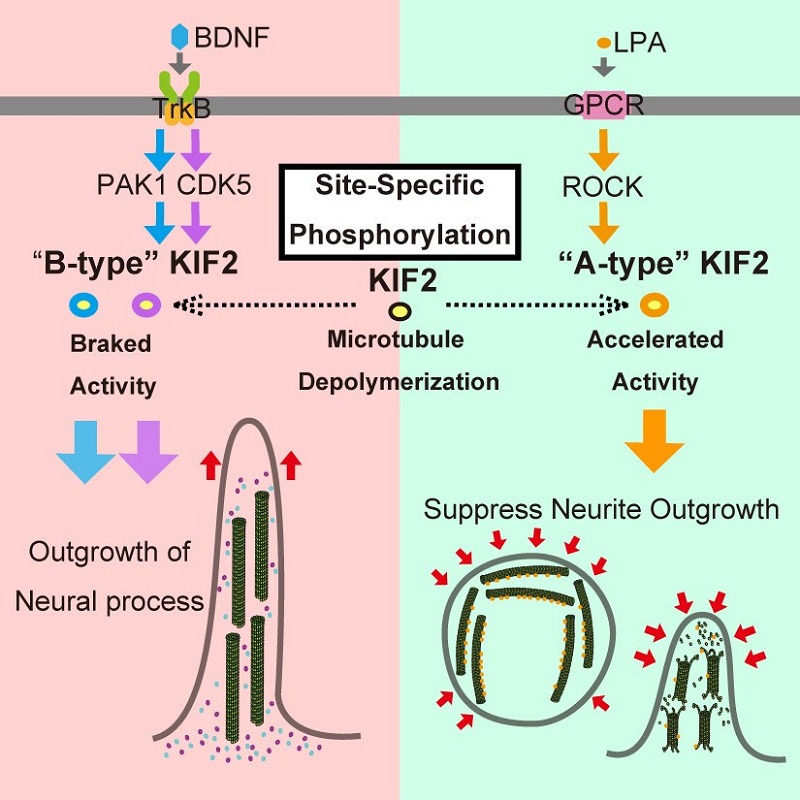
KIF2による微小管の脱重合反応のアクセルとブレーキ機構
神経細胞の突起が伸長する刺激(BDNF刺激)下ではキナーゼ(PAK1やCDK5)がKIF2の特定の部位をリン酸化し、ブレーキのようにKIF2の微小管の脱重合活性を抑えることで神経細胞の突起伸長を促す。突起伸長の開始を抑える刺激(LPA刺激)下ではキナーゼ(ROCK)がKIF2の別の部位をリン酸化し、アクセルのように微小管の脱重合活性を促し、突起の伸長を抑える。
© 2015 東京大学 廣川信隆研究室
東京大学大学院医学系研究科の廣川信隆特任教授と小川覚之特任助教らの研究グループは、細胞内の骨格である微小管の伸び(重合)縮み(脱重合)を制御する仕組みの一端を解明しました。本成果によって、脳内神経回路網がどのようにして形成されるかについての理解が深まりました。
私たちの体をつくる各々の細胞には微小管という細胞骨格があり、環境や発生段階の変化に応じてその形や働きを変化させます。細胞内のモータータンパク質KIF2(キネシンスーパーファミリー2)が微小管を脱重合する働きを持ち、脳の神経回路網の形成にかかわっていることはこれまでに知られていました。しかし、その活性がどのように外界の刺激に応答して制御されているのかは、未知でした。
そこで本研究グループは、神経細胞が外界の刺激に応答した際にKIF2がどのような物質の情報伝達によって制御されているのか調べるため、試験管内の条件で精製したタンパク質や哺乳類の培養細胞、マウスの神経細胞を用いて、細胞生物学・分子生物学・生化学などの手法を融合し、さらに質量分析法によって要となる現象を詳細かつ定量的に解析しました。その結果、複数のタンパク質リン酸化酵素(キナーゼ)がそれぞれ微小管を脱重合するタンパク質KIF2の別々の部位を識別してリン酸化し、アクセルとブレーキのように働くことによって微小管の重合・脱重合、すなわち伸び縮みを制御することを明らかにしました。この仕組みにより、神経細胞は置かれた状況や外界からの刺激に応じて微小管の伸び縮みを自在に制御して適応できるようにしています。
生命の維持や疾患の発症に重要な分子について、その制御機構を詳細に明らかにすることは生命の仕組みの解明のみならず、疾患の発症機序の解明にも貢献する可能性があります。「特に、神経細胞における微小管の脱重合の制御機構を明らかにしたことは、脳の神経回路網形成の基本的なメカニズムや、ひいては神経変性疾患の発症機序の解明や治療薬の開発に役立つことが期待されます」と廣川特任教授は話します。
プレスリリース [PDF]
論文情報
, "Microtubule Destabilizer KIF2A Undergoes Distinct Site-specific Phosphorylation Cascades that Differentially Affect Neuronal Morphogenesis", Cell Reports Volume 12, Issue 11, p1774-1788: 2015/9/4 (Japan time), doi:10.1016/j.celrep.2015.08.018.
論文へのリンク(掲載誌)






