BMPがマウスES細胞の未分化性を維持する仕組み 網羅的解析とゲノム編集法を使い定説を再検証

The roles of BMP signaling in naïve mouse ES cells
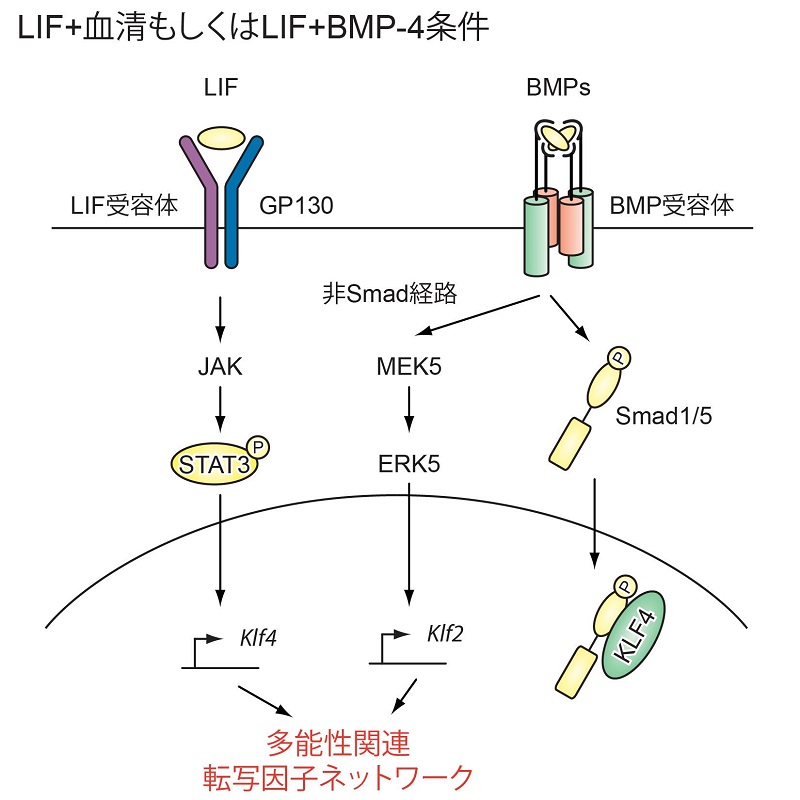
マウスES細胞では、BMP-4はSmad経路とMEK5-ERK5経路の両方の経路を活性化する。Smad経路は分化に関連した遺伝子を転写調節する。この経路では、ES細胞にのみ見られる転写因子KLF4がSmadに結合し、ES細胞が分化するのを抑えている。一方、MEK5-ERK5経路はKLF2を誘導することでマウスのES細胞の未分化な状態を維持する。
© 2016 Morikawa et al.
東京大学大学院医学系研究科の宮園浩平教授、鯉沼代造准教授らの研究グループはウプサラ大学との共同研究で、網羅的な解析法とゲノム編集法を駆使することで、マウスの万能細胞の一種である、胚性幹細胞(ES細胞)における骨形成因子(BMP)シグナルの役割を再評価し、これまでの定説とは異なる新たな分子機構を示しました。
骨形成因子(BMP)は、名前の由来となった骨の形成を誘導する働きだけではなく、生体内で多彩な機能を担っています。幹細胞の分野では、BMP-4は血清由来の重要な因子で、白血病阻止因子(LIF)とともにマウスのES細胞を未分化な状態で維持し、この作用には、細胞内の特定の情報伝達経路(Smad経路)の活性化が必要であると理解されてきました。しかし、ヒトのES細胞を含めた他の幹細胞の知見が集積するにつれて、BMPは幹細胞の分化を促進する場合も多いことも指摘されてきましたが、この相反する機能を説明しうる分子機構は未解明のままでした。
今回研究グループは、次世代シークエンサーを用いた網羅的解析とゲノム編集の手法を駆使し、マウスのES細胞を未分化な状態に維持するためにはSmad経路の活性化は必ずしも必要ではなく、BMP-4によって活性化される別の経路(MEK5-ERK5経路)が担っていることを明かにしました。
「幹細胞の分野ではMEK5-ERK5経路の働きはあまり注目されていませんでした」と宮園教授は話します。「異なる種類のマウスのES細胞を用いても検証しましたが、ES細胞を未分化な状態に保つためにこの経路が重要でした。今回用いたマウス群に限った機構ではなく、より一般化できる機構である可能性があります」と続けます。
この成果は、より適切なES細胞やiPS細胞をそのままの状態で維持する手法の開発や、より初期状態に近い高品質のヒトiPS細胞を樹立する樹立法の開発に貢献するものと期待されます。
なお、本成果は、東京大学先端科学技術研究センターゲノムサイエンス分野の油谷浩幸教授、スウェーデン ウプサラ大学ルードヴィック癌研究所Carl-Henrik Heldin教授、森川真大博士研究員らと共同で行われたものです。
論文情報
, "BMP sustains embryonic stem cell self-renewal through distinct functions of different Krüppel-like factors", Stem Cell Reports Online Edition: 2016/1/12 (Japan time), doi:10.1016/j.stemcr.2015.12.004.
論文へのリンク(掲載誌、UTokyo Repository)






