自然免疫応答の新しい活性化の機構を解明 タンパク質STINGはゴルジ体で活性化する

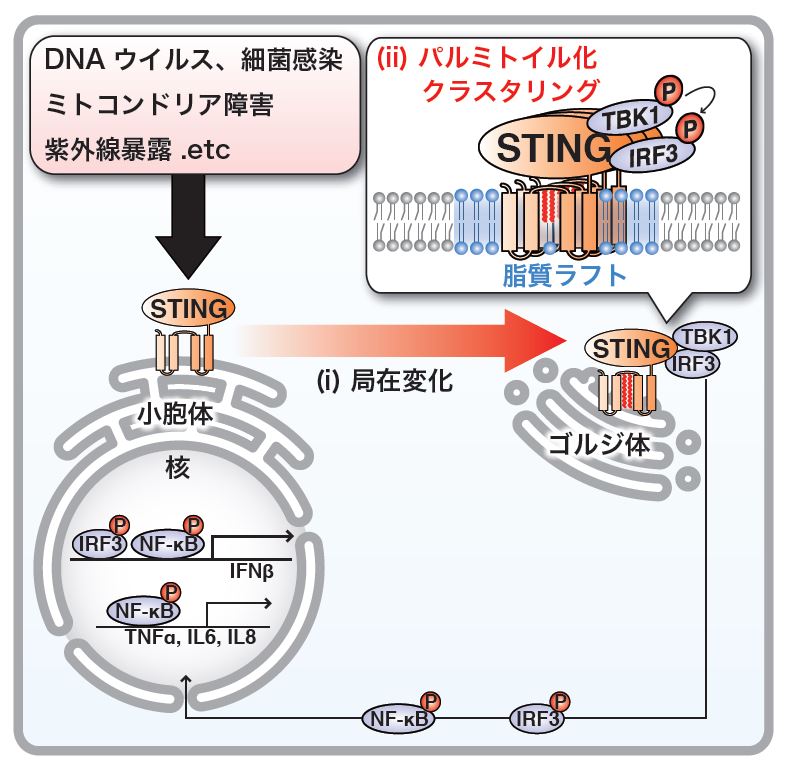
タンパク質STINGはゴルジ体でパルミトイル化されて活性化する
(i) DNAウイルス感染などが起きると、それに応じてタンパク質STINGはゴルジ体に移動する。(ii)ゴルジ体でタンパク質STINGはパルミトイル修飾を受け、脂質ラフト上でクラスタリングし、下流のシグナル分子(TBK1/IRF3)を活性化する。
© 2016 Kojiro Mukai
東京大学大学院薬学系研究科の新井洋由教授らの研究グループは、病原体の感染を察知し1型インターフェロン応答を誘導する自然免疫分子STINGの活性化機構を世界で初めて明らかにしました。本成果は、将来的に感染症、炎症関連疾患の治療法の開発につながると期待されます。
DNAウイルスやバクテリアなどの異物が細胞に感染した際に細胞内に持ち込まれるDNAは、小胞体の膜に埋め込まれたタンパク質STINGによって感知され、異物を排除するためのI型インターフェロンおよび炎症応答を引き起こします。この反応は、私たちの体が異物を認識し排除する自然免疫と呼ばれる基本的な反応です。しかしながら、なぜ細胞内のDNAに対する応答が膜タンパク質STINGを利用して起きるのかは不明でした。またSTINGは細胞内のDNAを感知したのちに、小胞体から核に近い場所に移動することも示されていましたが、その意義も不明でした。
今回、研究グループは、細胞生物学的な手法を用いた解析により、(i)タンパク質STINGの活性化の場が、細胞内のDNAを感知する小胞体ではなくゴルジ体であること、(ii)タンパク質 STINGの活性化にゴルジ体で起きる翻訳後の修飾であるパルミトイル化とゴルジ体のユニークな脂質環境の二つが必要であることを明らかにしました。
タンパク質STINGを介した炎症応答は、病原体感染時のみならず、自己免疫疾患、ガン、ミトコンドリア障害、紫外線暴露時など多様な局面での炎症応答に関与することが明らかとなってきています。今回の結果から、細胞内小器官の脂質環境を制御することが、炎症応答を制御する新しい手段となることが期待されます。
「私たちは今回自然免疫応答における細胞内小器官の膜リン脂質の重要性を初めて明らかにしました。本成果を糸口に感染症、免疫関連疾患、ガンの治療法の開発につながれば」と新井教授は話します。
論文情報
, "Activation of STING requires palmitoylation at the Golgi", Nature Communications: 2016/06/21 (Japan time), doi:10.1038/ncomms11932.
論文へのリンク(掲載誌)






