細胞内タンパク質分解装置の生産を調節する分子機構 新たながん治療薬の創薬に向けて

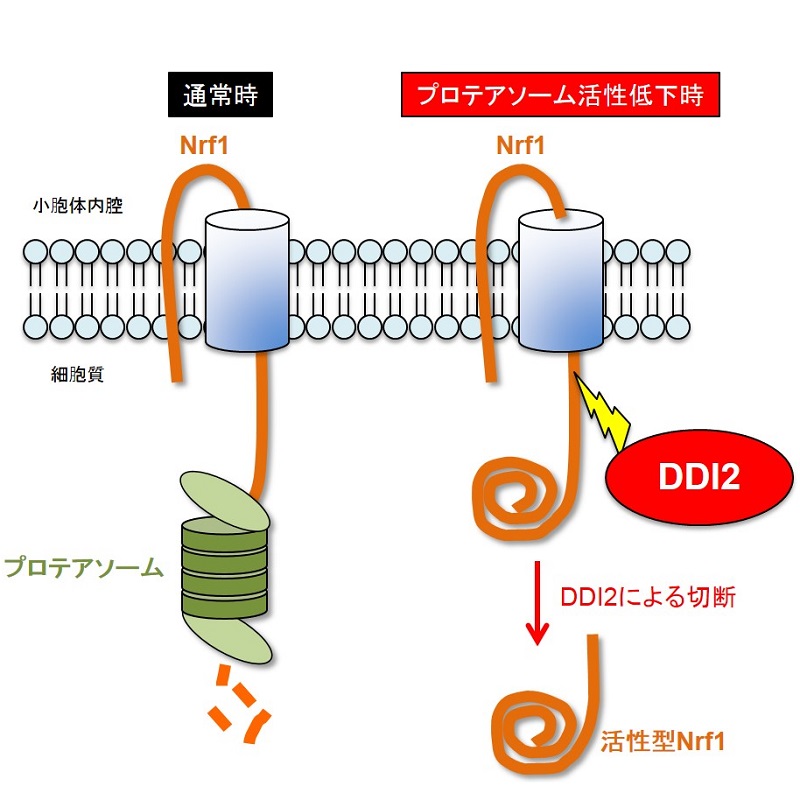
タンパク質分解酵素DDI2は転写因子Nrf1を切断することでプロテアソームの生産を促進する
転写因子Nrf1は通常、プロテアソームにより分解される。プロテアソームの活性が低下するとNrf1が蓄積し、DDI2により切断され、小胞体から移動して核で転写因子として機能する。
© 2016 Shigeo Murata.
東京大学大学院薬学系研究科の村田茂穂教授らの研究グループは、DDI2と呼ばれるタンパク質を分解する酵素が、複数のタンパク質からなる巨大なタンパク質分解酵素「プロテアソーム」の産生を促進するために必要であることを明らかにしました。本成果は、新しいがん治療薬の開発につながると期待されます。
プロテアソームは細胞内に存在する巨大な分子で複数のタンパク質が結合したタンパク質分解酵素複合体です。細胞内で不要になったタンパク質や傷害を受けたタンパク質のみを分解することによって、細胞機能の発現と維持に必須の働きを持ちます。そのため、適切なプロテアソーム量の調節は、身体を健全に保つために重要な機構です。プロテアソームによるタンパク質分解機能が低下した際には、Nrf1と呼ばれる転写を制御するタンパク質(転写因子)が活性化し、プロテアソームの産生を増やします。しかし、その詳細な分子機構には不明な点が多く存在していました。
今回、研究グループは、ヒトの培養細胞において転写因子Nrf1の活性化を担う因子を網羅的に探し、DDI2と呼ばれるタンパク質分解酵素がNrf1の活性化、そしてプロテアソーム産生の促進に必要であることを初めて明らかにしました。
Nrf1によるプロテアソーム産生の促進はタンパク質分解機能の維持に必須である一方で、プロテアソーム機能の異常な促進は、がん細胞の増殖に寄与していると考えられています。実際に、プロテアソームの機能が阻害されると、多発性骨髄腫等のがん治療に有効であることが示されています。
「私たちは今回、プロテアソームの産生を促す新しい分子機構を明らかにしました」と村田教授は話します。「今回の研究をきっかけに、プロテアソームの機能を阻害するような薬が開発されて、阻害薬によるがんの治療法の改良につなげられれば」と続けます。
論文情報
, "The aspartyl protease DDI2 activates Nrf1 to compensate for proteasome dysfunction", eLife Online Edition: 2016/08/16 (Japan time), doi:10.7554/eLife.18357.
論文へのリンク(掲載誌)






