ビフィズス菌が腸の中で増えるために持つ酵素のかたちを解明 ヒトの糖鎖をエサにするための酵素のユニークな特徴

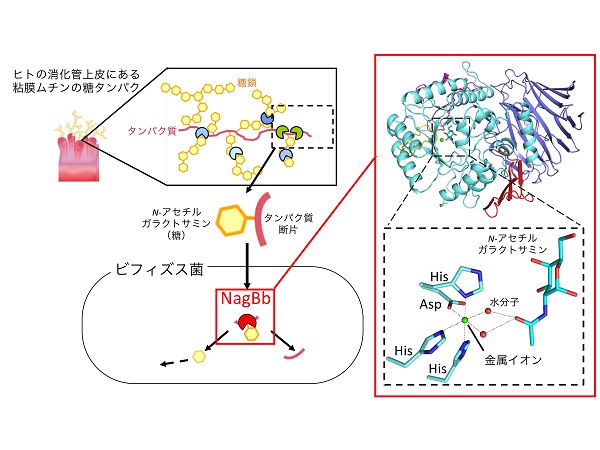
ビフィズス菌がヒトの腸内粘膜の糖タンパク質(ムチン)を利用する仕組み(左)とα-N-アセチルガラクトサミニダーゼ(NagBb)の全体と活性部位の構造(右)
(左)ビフィズス菌は種々の酵素を放出して糖鎖やタンパク質を分解した後、菌体内に取り込む。その断片はNagBbにより糖とタンパク質に分解される。(右)活性部位では、基質の糖(N-アセチルガラクトサミン)の認識に金属イオン(緑の球)が関わっている。
© 2017 Shinya Fushinobu.
東京大学大学院農学生命科学研究科の伏信進矢教授、荒川孝俊助教、佐藤真与大学院生らの研究グループは、ビフィズス菌がヒトの腸内において糖鎖を分解して定着・増殖するのに関わる酵素の立体構造と機能を明らかにしました。本研究は、増殖を変化させることにより宿主に好影響を与える新たなビフィズス菌増殖因子(プレバイオティクス)の開発にもつながることが期待されます。
ビフィズス菌はヒトの腸内に共生し、健康に有用な善玉菌として注目を集めている微生物です。ビフィズス菌はヒトと共生するために様々な生存戦略を取っていることが研究によって解明されてきましたが、その一つとして、腸管粘膜の上皮にある糖タンパク質(ムチン)の糖鎖をエネルギー源として生育に利用していることが明らかになってきました。 研究グループは、ビフィズス菌がムチンの糖鎖を利用する際に重要な酵素である、α-N-アセチルガラクトサミニダーゼ(NagBb)に着目して研究を行いました。ビフィズス菌は種々の分解酵素を菌体外に放出することによって、ムチン糖鎖の糖やタンパク質を分解して、その断片(糖であるN-アセチルガラクトサミンとタンパク質の断片がつながった糖ペプチド)を菌体内に取り込みます。NagBbはその断片を糖とタンパク質断片に切断する役割を担います。この酵素の立体構造をX線結晶構造解析により初めて明らかにしました。NagBbの全体構造や切断反応を行う活性中心は、ビフィズス菌が持つ他の酵素と部分的に似ていました。一方で、その活性部位には、糖基質であるN-アセチルガラクトサミンの認識に金属イオンが関与しており、この金属が反応において非常に重要であることが明らかになりました。このような基質認識の機構は一連の酵素群においては初めての報告となります。
今回、NagBbの立体構造を解明することにより、ビフィズス菌が腸内の糖鎖を利用して定着・増殖する仕組みがより明確になりました。
「ビフィズス菌はヒトとの共生の過程でこのようなユニークな酵素を獲得して進化させてきたのでしょう」と伏信教授は話します。「今後、新たなプレバイオティクスの開発につながれば」と期待を寄せます。
論文情報
, "The First Crystal Structure of a Family 129 Glycoside Hydrolase from a Probiotic Bacterium Reveals Critical Residues and Metal Co-factors", Journal of Biological Chemistry Online Edition: 2017/05/25 (Japan time), doi:10.1074/jbc.M117.777391.
論文へのリンク(掲載誌)






