酵素に頼らない化学触媒を開発 がんの新たな治療技術などにつながると期待

今回開発した触媒系の概要
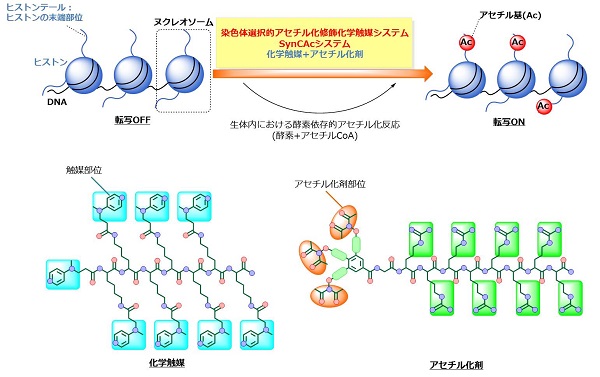
生体内では酵素によって促進されるヒストンのアセチル化修飾を、今回開発した人工化学触媒システム(SynCAcシステム)は酵素に依存せずに触媒とアセチル化剤の組み合わせで人工的に行うことができる。また、アセチル化修飾を受けたヒストンは転写が促進される性質があることが知られている。
© 2017 Motomu Kanai.
東京大学大学院薬学系研究科の金井求教授、川島茂裕特任講師、山次健三助教らのグループは、染色体に対してアセチル化という化学修飾を選択的に行う人工化学触媒システムを開発しました。さらに、本触媒システムを用いてヌクレオソーム(染色体の最小単位)をアセチル化することにより、遺伝子の転写を人工的に促進できる可能性が示唆されました。
ヌクレオソームは、ヒストンと呼ばれるタンパク質とDNAの複合体から構成されています。ヒストンは生体内の酵素によって、アセチル化に代表される種々の化学修飾を受けます。これらの化学修飾は遺伝子の転写制御に深く関与しています。特に、ヒストンのアセチル化修飾は、がん抑制遺伝子などの遺伝子の転写を促進することが知られています。
本研究グループは、DNAを認識してヌクレオソームに結合する触媒とアセチル化剤の組み合わせから成る人工化学触媒システムを開発することで、生体内の酵素を介さずにヒストンを人工的にアセチル化修飾することに成功しました。さらに、この人工的な化学修飾がヌクレオソームの性質を変化させ、遺伝子の転写を促進する可能性を見出しました。また、人工化学触媒システムを適切に変えることで、アセチル化に限らずマロニル化反応も進行できたことから、広く他の化学修飾への応用が示唆されました。
今後、この人工化学触媒システムは、生体内反応の機能を解明するのに有用な実験技術の開発や、生体内酵素による触媒反応との代替により治療効果をもたらす「触媒医療」への応用が期待されます。すなわち、新たな疾患治療ツールとして将来の医療の進歩に貢献することが期待されます。
「この研究は生物を専門とする研究者達と化学を専門とする研究者達が1つ屋根の下で密に議論しながら研究を進めることで初めて成し遂げられた成果です」と金井教授は話します。また、「今回の成果により、我々が提唱している「触媒医療」の実現に向けた最初の一歩を踏み出せました。今後は、さらに優れた人工化学触媒の開発に取り組んでいきます」と川島特任講師は今後の展望を語ります。さらに、山次助教は「生命は分子とその間に働く化学反応によって駆動されています。化学の力で生命研究や医療へとさらに貢献していきたい」と意欲を見せます。
なお本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業の一環として行われたものです。
論文情報
, "Synthetic chromatin acylation by an artificial catalyst system", Chem Online Edition: 2017/06/09 (Japan time), doi:10.1016/j.chempr.2017.04.002.
論文へのリンク(掲載誌)






