1つのアミノ酸の違いが日本人胃がん多発の背景に ピロリ菌の発がん活性を規定する分子構造基盤

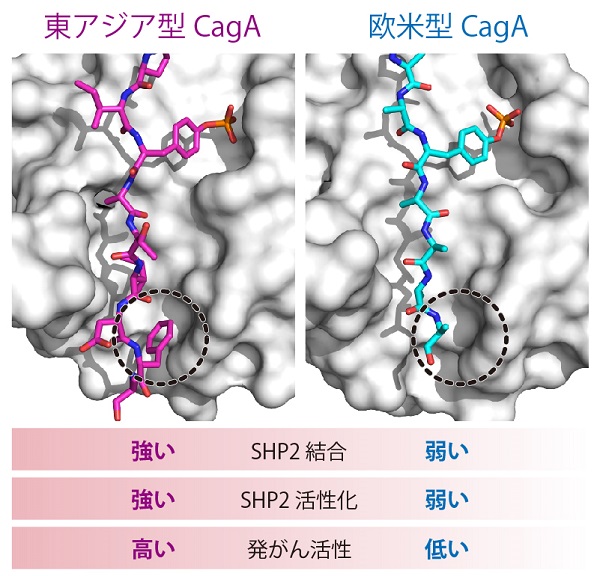
ピロリ菌CagA-SHP2結合の分子構造と発がん活性
SHP2(グレーの分子表面描画モデル)に結合した東アジア型CagA(マゼンタ、左)と欧米型CagA(シアン、右)の立体構造を解明した。黒色の点線で囲った部位において1つの異なるアミノ酸の構造がCagAのSHP2結合に影響を与えSHP2の活性化を左右する結果、発がん活性の強さに違いを生じる。
© 2018 畠山研究室
東京大学大学院医学系研究科の畠山昌則教授、林剛瑠助教ならびに高エネルギー加速器研究機構の千田俊哉教授らの研究グループは、日本を含む東アジアに蔓延するピロリ菌が保有する病原因子CagAが、ヒトの発がんタンパク質を強力に活性化し、胃がん発症リスクを著しく高める仕組みを原子レベルで解明しました。本研究の成果は、新規の胃がんの治療法や予防法の開発につながることが期待されます。
東アジア諸国(日本、中国、韓国)は世界的な胃がんの最多発地域として知られ、日本の年間の胃がん死亡者数は5万人にも上ります。ほとんどの胃がんはヘリコバクター・ピロリ(ピロリ菌)の感染を背景に発症し、その発がん過程にはピロリ菌が産生する病原因子CagAタンパク質が重要な役割を果たします。興味深いことに、疫学調査から東アジアで見られるピロリ菌が保有するCagA(東アジア型CagA)は、それ以外の地域で見られる世界標準のCagA(欧米型CagA)に比べ、胃がん発症により深く関与することが指摘されています。しかしながら、これら2種のCagA間の発がん活性に違いが生じる分子構造基盤は不明でした。
今回研究グループは、X線結晶構造解析を通してCagAが標的とする発がんタンパク質SHP2との複合体の立体構造を原子レベルで解明しました。その立体構造の比較から、欧米型CagAと東アジア型CagAの間に存在する1つのアミノ酸残基の違いによって生じる分子構造の差異が、CagAのSHP2結合能に大きな影響を与えることを明らかにしました。さらに、東アジア型CagAが示す欧米型CagAに比べて圧倒的に強固なSHP2結合が、SHP2の酵素活性を著しく増強し、胃の細胞のがん化を促す異常なシグナルを強力に誘導することを見出しました。これらの結果から、日本において高い胃がん発症リスクを招く東アジア型CagAが強い発がん活性を発揮するための分子構造的な仕組みが初めて明らかになりました。
「日本のピロリ菌感染者はCagA分子間のたった1つのアミノ酸の構造の違いにより高い胃がん発症リスクに晒されていることになります」と畠山教授は話します。「今後、革新的な胃がんの予防法・早期治療法の開発につながれば」と医療への展開に期待を寄せます。
プレスリリース [PDF]
論文情報
, "Differential Mechanisms for SHP2 Binding and Activation Are Exploited by Geographically Distinct Helicobacter pylori CagA Oncoproteins", Cell Reports Online Edition: 2017/09/20 (Japan time), doi:10.1016/j.celrep.2017.08.080.
論文へのリンク(掲載誌)






