肺がん転移を駆逐するメカニズムを発見研究成果

肺がん転移を駆逐するメカニズムを発見
1.発表者: 南 敬(東京大学先端科学技術研究センター 特任教授)2.発表のポイント:
- 肺がんの転移を抑制するブレーキ因子(DSCR-1)、転移を加速させるアクセル因子(Angiopoietin (Ang)-2)を発見した。
- DSCR-1とAng-2を制御することで、血管内皮(注1)の恒常性(注2)を保ちつつ、がん細胞が入ったあとでも肺への転移を効率よく駆逐することに成功した。
- 副作用を抑えた肺がんの新規転移抑制法の確立に繋がる。
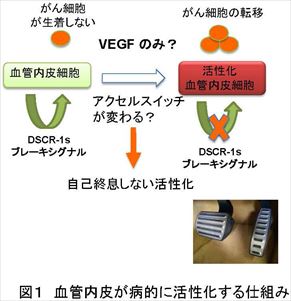
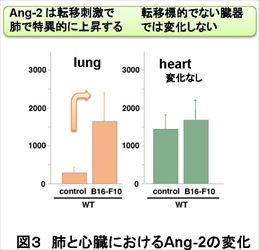
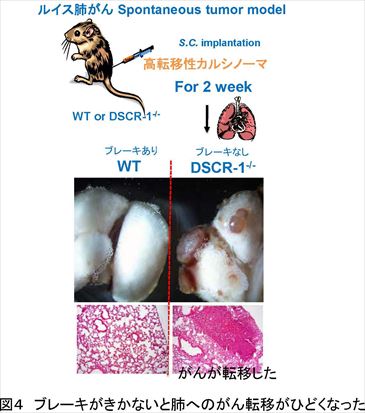
がんの増殖や、その環境悪化によって生じるがんの転移には、酸素・栄養供給源や通路となる血管が欠かせない。この血管構築 (血管新生) を止める薬剤 (VEGF 中和抗体アバスチン) が現在がん治療に使われているが、正常血管にも副作用がある懸念もあり、血管内皮の恒常性を正常に保ちつつ、がんの転移を防ぐ薬剤の開発が課題となっている。 今回、東京大学先端科学技術研究センターの南 敬特任教授と米国ペンシルバニア大学がん研究所 Sandra Ryeom博士らは、VEGFの刺激を制御するダウン症因子であり、かつ血管ではがんや炎症を駆逐するブレーキ因子として機能しているDown syndrome critical region (DSCR)-1 に着目し、遺伝子を変異させたマウスを使ってDSCR-1の有無とがん転移の関係を解析した。その結果、DSCR-1 を多く発現するマウスでは、肺へのがん転移が止まる一方、DSCR-1を欠いたマウスでは肺がん転移が早期に成立しただけでなく、初期に発生した腫瘍が小さくても、肺への転移が早く進むことを明らかにした。さらに、VEGF刺激に応じて、肺でAngiopoietin (Ang)-2が特異的に上昇し、Ang-2を中和する薬剤を発現させると、マウスの肺がん転移が強く抑制されることを発見した。VEGF刺激が増加するとブレーキ因子であるDSCR-1が増える現象、VEGF刺激の増加に応じてアクセル因子であるAng-2が肺で特異的に増える現象は、いずれも肺にがんが転移した患者の臨床データでも確認された。 肺がん転移のブレーキとなるDSCR-1には血管内皮細胞の恒常性を保ちつつ、異常活性化や病的血管新生のみを防護するという働きもあることから、DSCR-1やAng-2を制御することで、副作用を抑えたがん転移抑制の新たな治療法につながることが期待される。
4.発表内容:
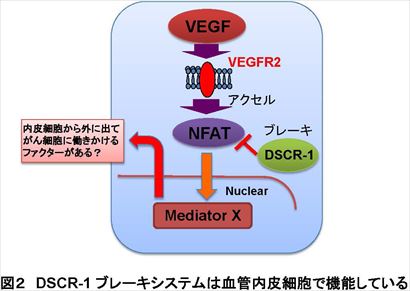
現代の高齢化社会において、脳卒中、心筋梗塞の素因となる動脈硬化、血栓症や病的血管新生に起因するがん増殖、転移での死亡率は年々増加する傾向にある。これら3大疾病には必ず血管が密接に関与しており、病気を引き起こす根本原因となり得る。従って、血管構築の礎となる血管内皮細胞に焦点をおき、その恒常性維持システムや活性化原理を解明する基礎的アプローチは有効であると考えられている。 血管の病気は臓器特異的で、血管恒常性の破綻した部位に限局して生じる特徴があるが、がんは、新たに血管を作り出し、そこから栄養を得ることで増殖や転移を繰り返すため、血管を含めた微小環境やその動態を研究することが各臓器への転移を抑制するために重要である。 現在、がんを兵糧攻めにすることを目的として、血管内皮細胞の増殖・血管新生阻害効果をもたらす、VEGF 中和抗体 (アバスチン)が臨床現場でも使われているが、正常血管にも副作用がある懸念や逆に転移を誘発してしまう研究報告も複数出てきていることから、血管の恒常性を保ちつつ、がんの転移を防ぐ薬剤の開発が課題となっている。 東京大学先端科学技術研究センターの南特任教授らは、炎症・凝固因子などの刺激で最も強く誘導されるダウン症因子 Down syndrome critical region (DSCR)-1が、自らの活性化シグナルを止める自己終息ブレーキ因子であったことに着目して研究を進めてきた。南特任教授らは、これまでの研究で、DSCR-1 は神経ではダウン症発症にも寄与する一方、血管内皮細胞では炎症・腫瘍環境下で防護的に作用していること、さらに、ダウン症患者が疫学的に固形がん(注3)にかかりにくいのは、がん発症のブレーキ因子として DSCR-1が寄与していることを明らかにしてきた。 がんの転移に関する本研究でも、南特任教授らはこのDSCR-1 に着目し、米国ペンシルバニア大学がん研究所 のRyeom 博士らと共同で、DSCR-1 モデルマウスを使ってがんの転移への影響を解析した。その結果、DSCR-1 を多く発現するマウスでは肺へのがん転移が止まるのに対し、DSCR-1を欠いたマウスでは肺がん転移が早期に成立することを見出した。このがん転移は原発腫瘍(注4)の大きさに関係なく、肺におけるVEGF 量と相関して転移が進んでいることを発見した。また、転移モデルマウスの肺血管内皮では、がんが転移する以前にVEGFの刺激が増え、転移先の肺でがんが転移する環境にあらかじめ変化していたが、これは肺にがんが転移した患者の臨床データからも同様のことが確認された。 さらに、 VEGF 刺激に応じて肺血管内皮ではサイトカイン Angiopoietin (Ang)-2が強く誘導され、がん細胞の転移を誘発していることも突き止めた。この Ang-2 を止める可溶型のおとり受容体(注5)をマウスに安定発現させたところ、がん細胞が入った後でもそれが肺に転移するのを効率良く抑制できることが判明した。 Ang-2 は肺がん患者の臨床データでも、肺の原発腫瘍よりも他臓器(胃や大腸)から肺に転移したがん周囲の血管内皮細胞に最も強く発現していることが確認された。 今回、内皮細胞研究から見出したブレーキ因子 DSCR-1 は内皮細胞の安定性を保ちつつ、異常活性化や病的血管新生のみを防護できるため、副作用の少ない薬剤の開発につながることが期待される。また、今回、がん細胞が肺に入ったあとでも、アクセル因子Ang-2を止めることで転移が抑制されることを確認した。これは、患者の肺へ転移したがんを駆逐する薬剤の開発や転移抑制法の確立につながると期待される。内皮細胞を軸としたがん研究は、がん転移抑制に関わる新たな標的探索の基本ツールとして、新しい治療開拓の大いなる可能性を秘めているといえる。
5.発表雑誌:
雑誌名:「Cell Reports」
論文タイトル:The Calcineurin-NFAT-Angiopoietin 2 signaling axis in lung endothelium is critical for the establishment of lung metastases 著者:Takashi Minami*, Shuying Jiang, Keri Schadler, Jun-ichi Suehiro Tsuyoshi Osawa, Yuichi Oike, Mai Miura, Makoto Naito, Tatsuhiko Kodama, and Sandra Ryeom*
6.問い合わせ先:
東京大学先端科学技術研究センター 特任教授 南 敬
7.用語解説:
(注1)血管内皮:血管の内表面を構成する扁平で薄い細胞の層で、血液の循環する内腔と接している。血小板機能、凝固線溶系を制御し、血管内で血栓が形成されないようにしている。
(注2)恒常性:外界の変化に対応して生物が一定の状態、構造などを保とうとする性質。一定の状態が保たれている人間の体温や血管において見られる。
(注3)固形がん:胃、肺、大腸、肝臓、乳房、子宮など形のある臓器に塊となって発生するがん。
(注4)原発腫瘍:最初に発生した腫瘍。
(注5)おとり受容体:本来受容体が認識する特異的物質(リガンド)に結合するが細胞内にシグナルを伝えない、いわば「おとり」として働く受容体。
8.添付資料: