細胞外で複製し進化する人工ゲノムDNAを開発~自律的に増殖し進化する人工細胞の構築に期待~研究成果

掲載日:2021年11月16日
発表者
市橋 伯一(東京大学 大学院総合文化研究科 広域科学専攻・附属先進科学研究機構/生物普遍性連携研究機構 教授)発表のポイント
- 生物はゲノムDNAに書かれている情報を使ってDNAを複製し進化することができるが、この能力を持つ人工物はいまだ作られていない。
- 本研究では、人工ゲノムDNAと無細胞転写翻訳系を用いることで、細胞外で遺伝子を発現させながら複製するDNAを世界で初めて進化させることに成功した。
- この人工ゲノムDNAに遺伝子を追加することにより、将来的には自律的に増殖可能な人工細胞の構築が可能となり、効率的な有用物質生産に貢献すると期待される。
発表概要
JST戦略的創造研究推進事業において、東京大学 大学院総合文化研究科 広域科学専攻・附属先進科学研究機構/生物普遍性連携研究機構の市橋 伯一 教授らは、核酸やたんぱく質といった無生物材料のみを用いて、生物の特徴であるDNAからの遺伝子発現と持続的な複製による進化を細胞外で行うことに世界で初めて成功しました。増えることと進化することは生物の大きな特徴ですが、この特徴を持つ人工物はいまだに作られていませんでした。本研究グループは、DNA複製に必要な2つの遺伝子を持つ環状DNA(人工ゲノムDNA)と無細胞転写翻訳系注1)を用いることで、遺伝子がたんぱく質へと翻訳され、その翻訳されたたんぱく質によって元の環状DNAを複製させることに成功しました。さらにこのDNA複製サイクルを約60日間続けることで、複製効率が約10倍上昇したDNAに進化させることに成功しました。
今回開発した人工ゲノムDNAに転写翻訳に必要な遺伝子を追加していけば、将来的にはアミノ酸や塩基などの低分子化合物を与えるだけで自律的に増殖する人工細胞へと発展させることができます。そのような人工細胞ができれば、現在行われている医薬品開発や食料生産のような生物を使った有用物質生産がより安定で制御しやすいものになると期待できます。本研究成果は、2021年11月16日(米国東部時間)に米国科学誌「ACS Synthetic Biology」のオンライン版で公開されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「ゲノムスケールのDNA設計・合成による細胞制御技術の創出」(研究総括:塩見 春彦 慶應義塾大学 医学部 教授)
研究課題名:「自己再生産し進化する人工ゲノム複製・転写・翻訳システムの開発」
研究代表者:市橋 伯一(東京大学 大学院総合文化研究科 教授)
研究期間:令和2年11月~令和8年3月
研究の背景と経緯
増えることと進化することは生物の大きな特徴です。生物は増える能力を持っているため、食料や医薬品などの安価な生産に利用することができます。さらに進化できるため品種改良も可能です。しかし生物は人間に都合良くはできていないため、生物を使ったもの作りには制御性や安定性に限界があります。もし、増えて進化する能力を持つ人工分子システムを作ることができれば、今まで生物に依存していた有用物質生産をもっと効率的で安定に行うことができると期待されます。
生物の「増えて進化する能力」にとって最も重要な条件は、生物の設計図であるゲノムDNAを長い世代にわたって複製し続けることです。この複製中にゲノムDNAに変異が入り、もしその変異が子孫の数や生存に有利であれば、その変異が集団に広まることで進化が起きます。したがって、増えて進化する人工分子システムの開発には、まずDNAの複製を長期間にわたり起こし続ける必要がありました。さらに生物のように進化を起こすためには、ただDNAが複製すればよいわけではなく、DNAに書かれている情報(遺伝子)を翻訳してたんぱく質を発現させ、そのたんぱく質によってDNAを複製する必要があります。このようなDNA複製に必要な遺伝子の発現とそれによるDNA複製が同時に起こる反応系構築はこれまで達成されていませんでした。これを起こすための大きな障害は、DNA複製に必要な遺伝子が多数あり(大腸菌型のDNA複製では約20種類、ウイルス型では4種類)、さらにその一部は高濃度なたんぱく質が必要なために、現在の無細胞転写翻訳系ではそのすべてを十分な量で供給するのが難しいことでした。
研究の内容
そこで本研究グループは、生物が使っているような精巧ではあるものの多数の遺伝子を必要とする複雑なDNA複製機構ではなく、もっと少ない遺伝子かつ低濃度のたんぱく質で達成可能なDNA複製の仕組みを人工的に作ることにしました。今回用いたDNA複製の仕組みでは、わずか2種類の遺伝子(Phi29 DNA複製酵素注2)とCre組み換え酵素注3))で環状DNA(人工ゲノムDNAと呼びます)を複製することができます(図1)。まずPhi29 DNA複製酵素が環状DNAの中の不特定の場所から2本鎖DNAを引きはがしながら相補DNAを合成していきます。鋳型となるDNAは環状ですが、自身が合成したDNA鎖も引きはがしてさらに合成を続けるため、最終的に数十キロの塩基対におよぶ長い直鎖状1本鎖DNAを作ることになります。さらにDNA複製酵素が相補鎖を合成し、長い2本鎖DNAとなった後、Cre組み換え酵素が働き、loxPと呼ばれる34塩基対のDNA配列同士に対して相同組み換えを起こします。元々の環状DNAにloxP配列が1つ入っているため、その間で相同組み換えが起こると環状DNAが再生することになります。以上のDNA複製機構では、わずか2つの遺伝子で再帰的な環状DNAの複製が可能です。またその2つのたんぱく質も低濃度で十分機能し、現在の無細胞翻訳系で十分量を発現することができると予想されました。
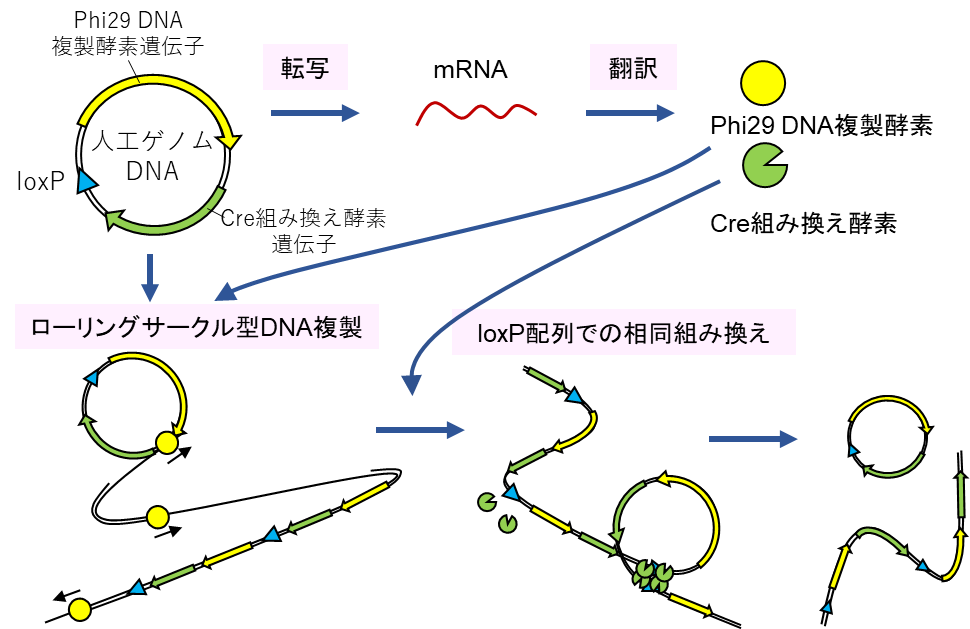
DNAから2種類のたんぱく質が発現し、Phi29 DNA複製酵素によって環状DNAから2本鎖の長い直鎖状DNAが合成される。その後、Cre組み換え酵素により分子内で相同組み換えが起こり、環状DNAが再生される。このときできる環状DNAの大きさはもとより2倍、3倍大きい可能性もある。また環状DNAにならず長い直鎖状DNAのまま複製する経路も存在する。このようなDNA複製の仕組みは2006年に海外のグループにより提案されていたが、Cre組み換え酵素がDNA複製酵素の機能を強く阻害してしまうために長年実現されていなかった(Forster et al 2006 Mol Sys Biol)。本研究グループの先行研究で阻害効果が少ないDNA複製酵素変異体が取得され(Sakatani et al 2018 Sci Rep)、本研究が可能となった。
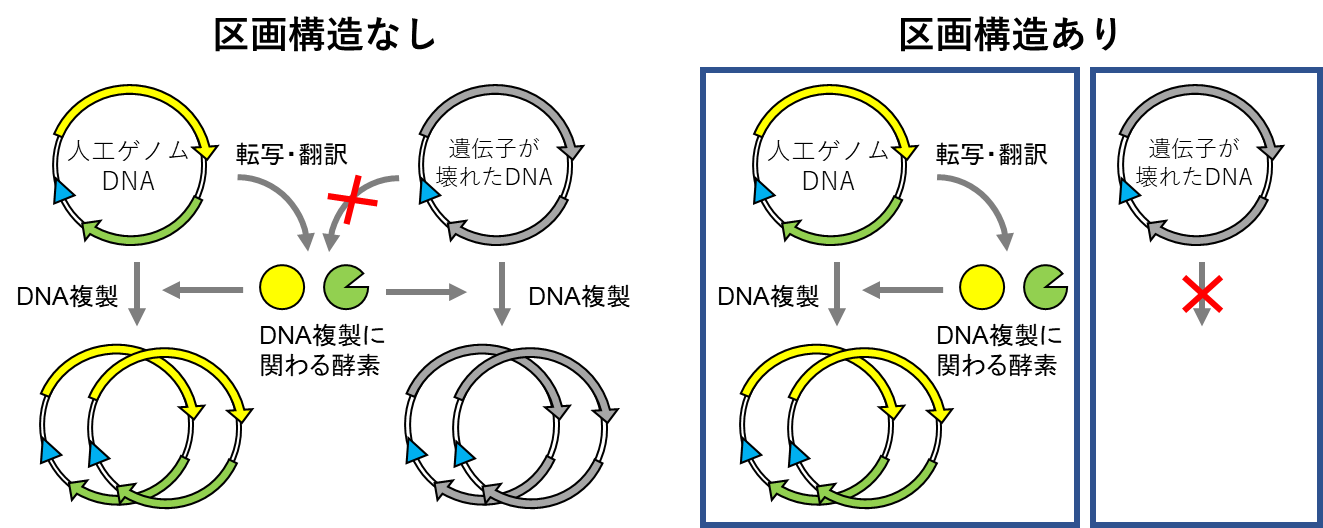
本研究ではまず、この人工ゲノムDNAを持続的に複製できるかを検証しました。人工ゲノムDNAを無細胞転写翻訳系で、図1に示す反応を行わせました。すると1000倍以上にDNAが複製されました(図2、ラウンド1)。DNAの持続的な複製を確かめるために、反応液の一部を取って新しい無細胞転写翻訳液で希釈し同じように次のラウンドの転写・翻訳・複製を行わせてみると、次は2倍程度にDNAが増えました(図2、ラウンド2)。この調子で何度も希釈と反応を繰り返し継代していくと、徐々にDNAの増えが悪くなり、8回継代後にはDNAが全く増えなくなりました。この理由は複製中に複製エラーにより遺伝子の機能を壊してしまう変異が入り、複製を繰り返していくといつかは遺伝子が壊れてしまうからです。問題は、そうした壊れた遺伝子を持つDNAも、他に正常な遺伝子から発現したたんぱく質によって複製され続けてしまい、最終的には正常な遺伝子がなくなって全体として複製が止まってしまうことです(図3左)。このような壊れた遺伝子を持つDNAを除く方法の1つは、細胞のように区画構造を導入し、細胞当たりのゲノムDNAの数を少数(できれば1個)に限定することです。こうすれば、壊れた遺伝子を持つDNAは正常なたんぱく質を作れないために複製することができず、そのうち希釈されてなくなるはずです(図3右)。このような区画構造として、直径0.5~0.8マイクロメートル(μm)の油中水滴を用いました。油中水滴は鉱油に界面活性剤と反応溶液を加えて激しくかき混ぜることで作ることができます。
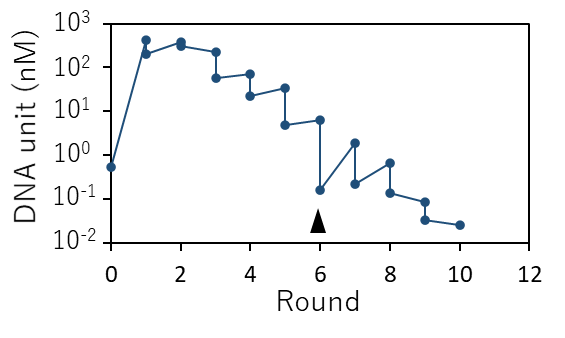
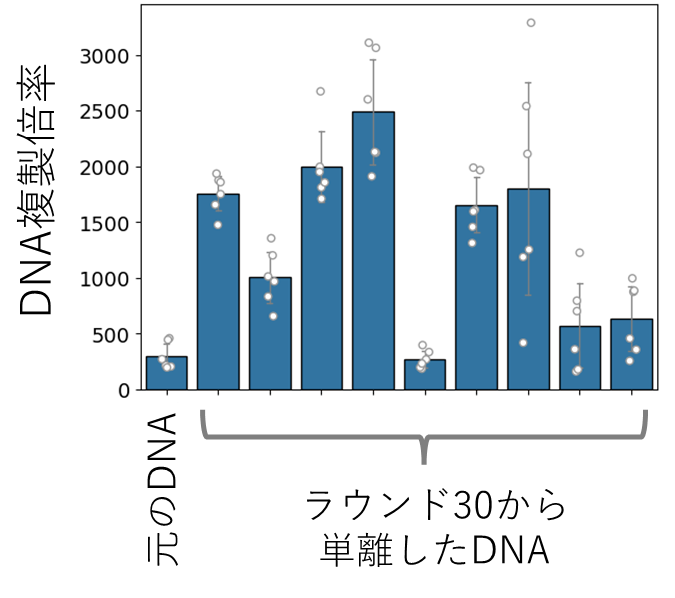
このようにして作った水滴中に人工ゲノムDNAと無細胞転写翻訳反応液を封入し、30度で16時間、図1に示すDNA複製反応を行いました。その後、図4Aに示すように新しい無細胞転写翻訳系を含む水滴で希釈し、次のラウンドの反応を行いました。このような区画構造中での継代反応を行うと、先の結果とは異なり、8ラウンド経過後も複製が持続しました(図4B)。そして当初は徐々にDNA濃度が低下する傾向にありましたが、18ラウンドになると急によく増えるようになり、60ラウンド(60日間、140 世代相当)までDNA複製を続けることができました。30ラウンドの時点でDNAを18個単離してその配列を調べたところ、平均7個の変異が入っており、そのうち5個は過半数のDNAに共通していました。また単離した多くのDNAの複製能力は元のDNAに比べて最大で約10倍まで上昇していました(図5)。このことは、適応進化が起きたことを示しています。ここで重要なのは、この実験で研究者が特に複製量の高いDNAを意図的に選択したわけではないことです。研究者が行ったのはただ毎日水滴を調整し、希釈し、30度で温めただけです。操作としては微生物を継代培養することと大差ありません。核酸とたんぱく質などの無生物分子の集まりをただ“培養”するだけでDNAが勝手に進化し始めた点に本研究の新規性があります。
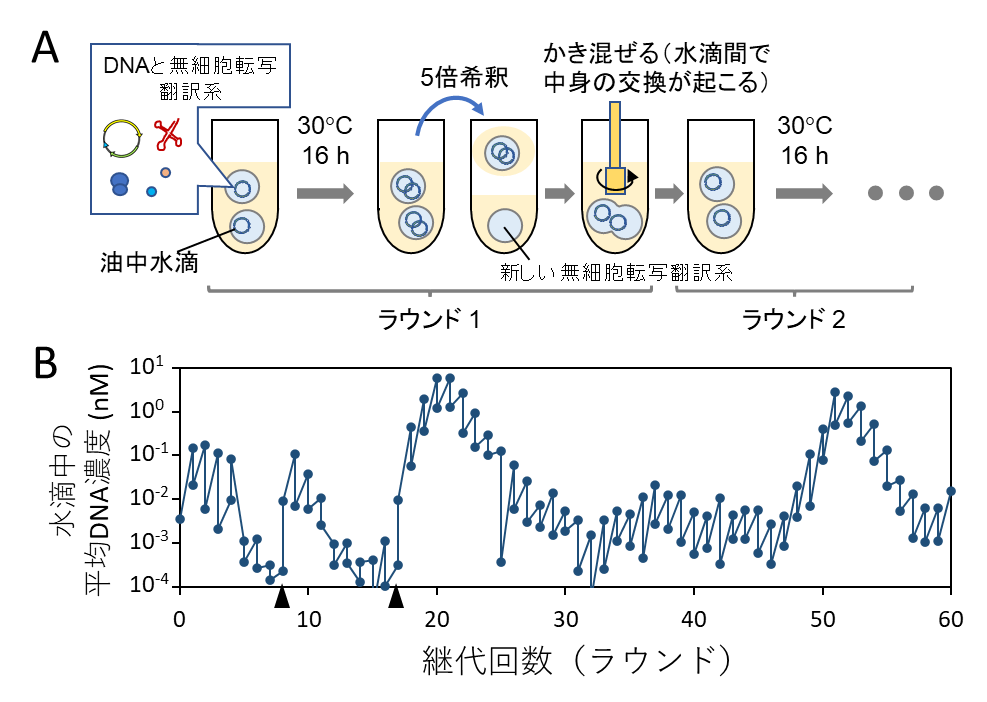
もう1つ興味深い現象として、DNA濃度の推移が大きく波打つように上がったり下がったりを繰り返していました(図4B、20ラウンドと50ラウンド前後で極大)。この現象は、おそらく寄生型のDNAが出現したためだと考えています。実際にDNA濃度が上がった20ラウンドあたりで増えたDNAを調べてみると、本来の人工ゲノムDNA以外に、DNA複製酵素と組み換え酵素の両方の遺伝子を欠損した100塩基長程度の繰り返し構造からなるDNAが過剰に増幅していました。このDNAはDNA複製に必要な遺伝子を持たないため単独では増えることができませんが、同じ区画内に正常なDNAが存在すればそれに寄生して増えることができます。同様な寄生型の複製体の出現と振動するような濃度推移は、本研究の著者らによるRNAの進化実験注4)でも観察されており(Furubayashi et al eLIFE 2020)、同じ現象がDNAの場合にも起きたと考えられます。寄生型の複製体は、RNA、DNA問わずすぐに出現したことは、寄生種の出現がゲノム複製系にとって一般的な現象であることを示唆しています。
今後の展開
現在の人工ゲノムDNAにはDNA複製に必要な2遺伝子だけが載っていますが、他の遺伝子を導入することで人工ゲノムDNAの持つ機能を拡張していくことができます。例えば、現在は無細胞翻訳系中に入っているRNAやたんぱく質もゲノムDNAから発現させることができるため、今後、転写翻訳に必要な遺伝子をすべて載せれば、アミノ酸や塩基などの低分子化合物を与えるだけで自律的に増殖をする人工分子システムへと発展させることができます。膜合成遺伝子を導入すれば、細胞膜を作り出せる可能性があります。また、翻訳したたんぱく質の機能が十分でなければ、進化させることでその機能を向上させることもできます。本研究で開発した人工ゲノムDNAをコアにすれば、自律的に増殖する人工細胞の構築につながることが期待されます。
このような自律的に増殖する人工分子システムができれば、現在、生物に頼っている医薬品開発や食料生産などをこのシステムに置き換えることができると考えられます。生物は丈夫で安定ですが、人間に都合良くはできていません。また生物の動作原理にはまだブラックボックスが多く残されています。そのため生物を使ったもの作りには常に制限が付きまといます。一方で人工的に構築した分子システムであれば、必要な要素しか入っておらず、すべて既知の物質で作ることができるため設計や制御が容易になります。将来は、このような人工システムを使うことで、生物を使っている現状の有用物質の生産をより安定して制御できることが期待されます。
用語解説
注1)無細胞転写翻訳系
細胞外でDNAにコードされた遺伝子からRNAを転写し、たんぱく質へ翻訳することに必要なすべての因子を含む反応液。本研究では特に、東京大学の上田 卓也 研究室で清水 義宏(現 理化学研究所 生命機能科学研究センター 無細胞タンパク質合成研究チーム チームリーダー)らによって開発された、すべて精製された既知のたんぱく質とRNAから構成されている再構成型のもの(PURE SYSTEM,Shimizu et al Nat Biotech 2001)を用いているため、不明要素のないシステムになっている。
注2)Phi29 DNA複製酵素
枯草菌のバクテリオファージphi29が持つDNA複製酵素。この酵素はDNAやRNAをプライマーとしてDNA鎖を合成できる。鎖置換活性があるため、2本鎖を分離しながらDNA合成を続けることができる。本研究では転写酵素によって作られたRNA断片をプライマーとして複製を行っていると予想される。
注3)Cre組み換え酵素
大腸菌のバクテリオファージP1が持つDNA組み換え酵素。loxPと呼ばれる34塩基長の配列同士を組み替えることができる。本研究で用いる人工ゲノムDNAは1つのloxPを持つ。
注4)RNAの進化実験
本研究で開発したような持続的に複製し進化するシステムは、過去に本グループのメンバーによりDNAではなくRNAで達成されていた(Ichihashi et al.Nat Commun 2013)。しかし、RNAゲノムの場合は持続的複製可能なRNAの長さに制限があり、遺伝子を追加することが難しく発展性に欠けるという問題があった。これに対し今回開発したDNAゲノムには今のところそのような制限はなく、複数の遺伝子の追加が可能でありさまざまな応用が期待される。
論文情報
Hiroki Okauchi and Norikazu Ichihashi*, "Continuous cell-free replication and evolution of artificial genomic DNA in a compartmentalized gene expression system," ACS Synthetic Biology: 2021年11月16日, doi:10.1021/acssynbio.1c00430.
論文へのリンク (掲載誌 )
)





