致死的な遺伝子変異に対しても細胞は適応できる-遺伝的変化に対する細胞の適応現象の発見-研究成果

掲載日:2022年5月10日
発表者
小金澤 優太(東京大学 大学院総合文化研究科 広域科学専攻 博士課程3年(研究当時))
梅谷 実樹(東京大学 大学院総合文化研究科 特任助教)
佐藤 守俊(東京大学 大学院総合文化研究科 広域科学専攻 教授/東京大学 生物普遍性連携研究機構 教授)
若本 祐一(東京大学 大学院総合文化研究科 広域科学専攻 教授/東京大学 生物普遍性連携研究機構 教授)
発表のポイント
- 大腸菌をモデルとして用い、致死的な遺伝子変異に対しても細胞は適応しうることを発見した。
- 特定の遺伝子変異のタイミングを光を照射することによって厳密に制御できる技術と、遺伝子変異前後の状態変化を1細胞レベルで長期観察できる技術を組み合わせることで、遺伝子変異の影響が表現型に波及する過程を1細胞レベルで直接可視化することに初めて成功した。
- 遺伝学の根幹をなす遺伝子型-表現型対応の理解に対し、遺伝子変異や環境変化の履歴の重要性が示された。
発表概要
東京大学大学院総合文化研究科の小金澤優太氏(研究当時大学院生)、梅谷実樹特任助教、佐藤守俊教授、若本祐一教授らの研究チームは、光照射によって特定の遺伝子を任意のタイミングで欠損させることが可能な遺伝子操作技術と、個々の細胞の状態変化を長期間観察し続けることができる細胞計測技術を組み合わせることにより、本来生存に必須な遺伝子を生細胞の中で欠損させても、遺伝子欠損前後に細胞が経験した環境によっては、一部の細胞が適応し成長を継続する「遺伝的変化に対する適応現象」を発見しました。この結果は、重要遺伝子の欠損という内的ストレスに対しても細胞は適応できること、また、ある遺伝子型(注1)のある環境でもたらす細胞の表現型(注2)が、過去の環境変化の条件に依存して変化することを1細胞レベルで明らかにしたものです。この性質は細菌の薬剤耐性の獲得機構などに対して新たな視点をもたらす結果と考えられます。本研究成果は、2022年5月10日(英国夏時間)に科学誌「eLife」のオンライン版に掲載されました。
発表内容
遺伝学において、遺伝子の機能や役割は遺伝子型と表現型の対応関係の解明を通じて理解されてきました。通常の遺伝学的解析では、遺伝子型変化の発生から充分に時間が経過した後に観察される安定表現型がその新たな遺伝子型がもたらす表現型であると捉え、遺伝子型-表現型対応が理解されています。一方で、同一環境下に置かれた細胞同士が、同じ遺伝子型変異を生じた場合、どの程度速やかに表現型の変化を引き起こすのか、その影響は個々の細胞に同じように現れてくるのか、最終的に同じ安定表現型に到達するのか、といった「遺伝子型変化が表現型変化へ波及していく過程・ダイナミクスの実態」の理解は、これまでほとんど進んでいませんでした。その背景には、特定の遺伝子変異が発生するタイミングを実験者が厳密に制御しつつ、その後の個々の細胞の表現型変化の過程を1細胞レベルで詳細に解析することが技術的に難しいという問題がありました。この問題に対し研究チームは、特定遺伝子の欠失を青色光照射により任意のタイミングで引き起こすことが可能なPhoto-activatable Cre(注3)(PA-Cre)システムという光遺伝学技術と、遺伝子型変化前後の細胞動態を1細胞レベルで長期間追跡観察できる1細胞計測技術を組み合わせた新たな計測法を構築し、この技術的な問題を解決しました(図1)。
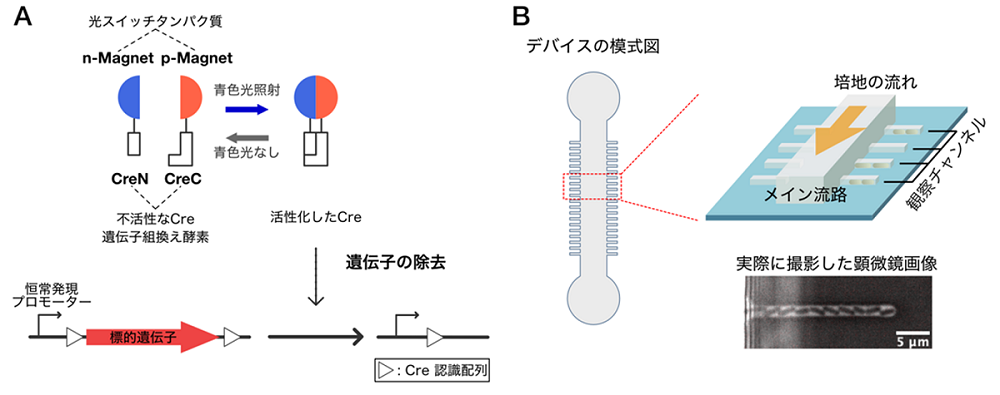
(B) 本研究で使用したマイクロ流体デバイス。このデバイスに大腸菌を導入し、培養液を流すことによって、顕微鏡下で一つ一つの細胞が増殖する様子を長期間追跡することができます。また、流れる培養液の種類を変えることで、細胞に任意のタイミングで環境変化を与えることが可能です。
研究チームは、この計測法を用いて、抗生物質クロラムフェニコール(注4)に対する耐性遺伝子を染色体に保持する大腸菌をモデルに用い、本来、この耐性遺伝子なしでは大腸菌が増殖できないと考えられる濃度のクロラムフェニコールが含まれる環境下で、細胞内の耐性遺伝子を除去する実験を行いました。その結果、耐性遺伝子が欠失されたにも関わらず、約40%の細胞がいったん成長をほとんど停止したあと徐々に回復し、やがて安定に成長・分裂を継続できるようになることを明らかにしました(図2)。また別の解析では、これらのクロラムフェニコール耐性遺伝子の欠失に適応し成長を回復した細胞において、その他の遺伝子変異は確認されなかったため、この適応は、細胞が追加の遺伝子変異なしにその生理状態を変化させることで実現したと考えられます。一方で、同じ耐性遺伝子の欠失をクロラムフェニコール投与の充分前に起こしておき、その後、先と同じ濃度のクロラムフェニコールを投与すると、成長を回復できる細胞は現れないことが分かりました。つまり、耐性遺伝子の欠失という同じ遺伝的変化を受けても、それに適応し同濃度の抗生物質に耐性を示すことができるかどうかは、遺伝子の欠失が生じるタイミングに依存することが示唆されます。
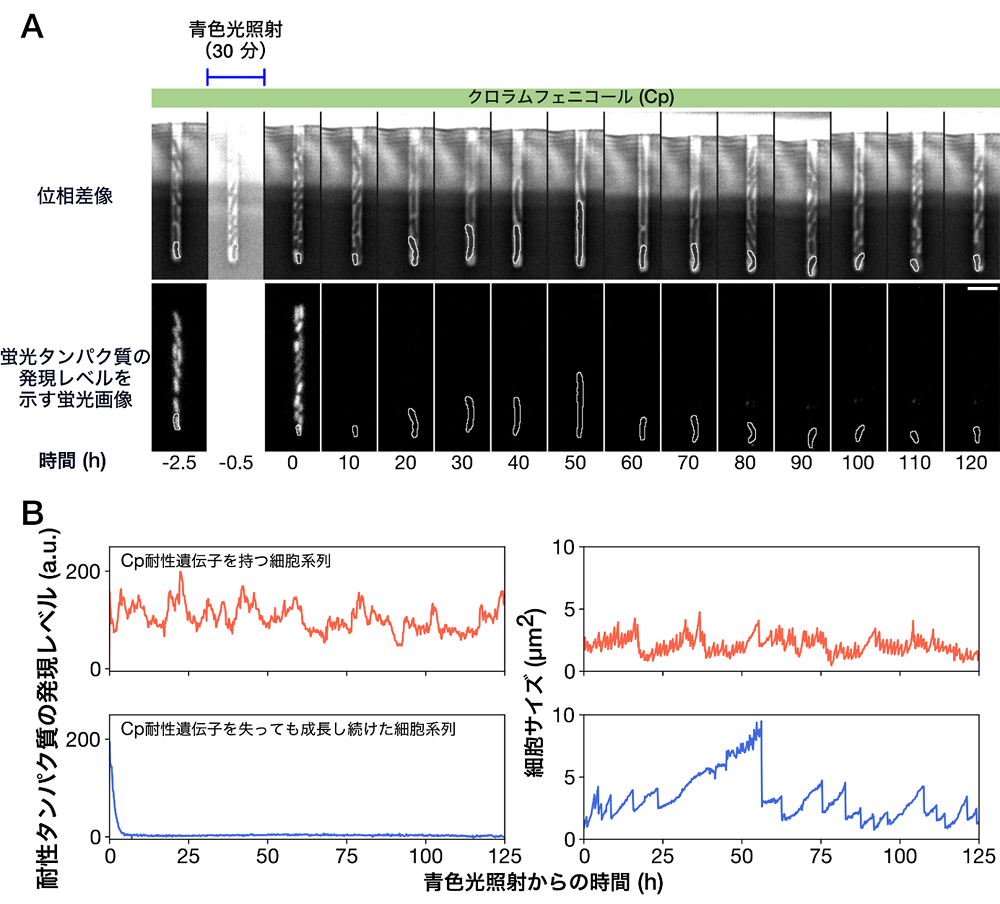
(B) 耐性タンパク質の発現レベルと細胞サイズの変化。上はCp耐性遺伝子を持つ細胞系列を表し、下は耐性遺伝子を失って分裂を継続した細胞系列を表しています。細胞サイズが半減するタイミングは細胞が分裂したタイミングを表しています。
研究チームはさらにこの解析を推し進め、遺伝子欠失からクロラムフェニコール投与開始までの時間をさまざまに変えた実験を行いました。その結果、遺伝子欠失からクロラムフェニコールの投与までの時間が3時間以内では成長回復できる適応細胞の割合はほとんど変化しない一方で、それ以上時間が経過すると適応細胞の割合は減少し、10時間以上では適応細胞が現れなくなることを明らかにしました(図3)。このように、遺伝的変化に対する適応が実現するかどうかは、遺伝的変化と環境変化のタイミングに強く依存することが示されました。
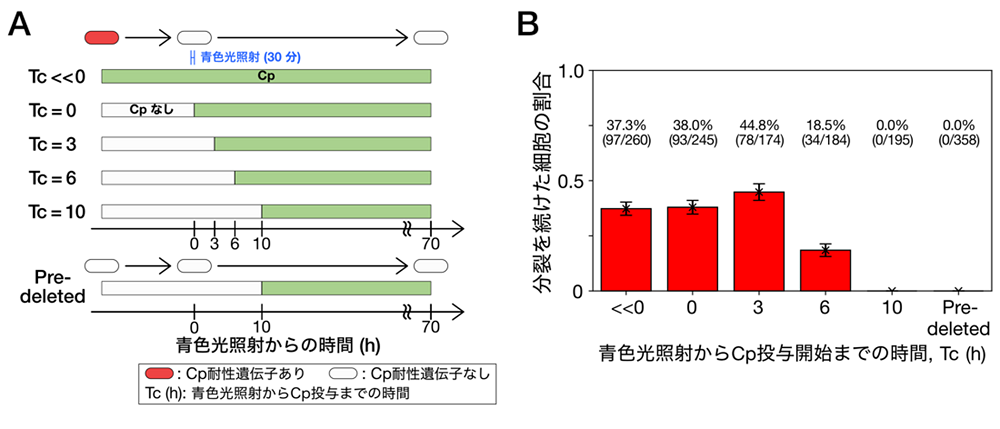
(B) (A)の実験の結果。3時間までは、適応細胞の出現頻度にほとんど変化はありませんでしたが、6時間の場合、出現頻度は低下し、10時間になると適応細胞は出現しませんでした。この結果により、遺伝的変化に対する適応における、遺伝子型変化と環境変化のタイミングの重要性が示唆されました。
また、このようなクロラムフェニコール耐性遺伝子除去という変化に対する適応の背景で、クロラムフェニコールの標的生体分子であるリボソーム(注5)の大サブユニット、小サブユニットの量比のバランスが細胞内でいったん崩れ、それが徐々に回復するという変化が起きることも明らかにしました。この結果は、観察された適応とリボソームの恒常性に相関があることを示唆しています。
以上の結果は、さまざまな外的ストレスに対して適応能を有している細胞は、自身の内部で発生した遺伝子型変化という内的ストレスに対しても、過去の環境変化の条件によっては適応しうることを初めて1細胞レベルで明らかにしたものです。またこの結果は、同じ濃度の薬剤に対し同じ遺伝子型を持つ細胞が異なる反応をしうることも示しており、薬剤耐性菌の出現、進化、拡散を考えるうえで重要な発見であると考えられます。
本研究は、JST ERATO「深津共生進化機構プロジェクト(課題番号:JPMJER1902、研究代表者:深津武馬)」、JST CREST「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出(研究総括:松田道行)」における「ライブセルオミクスと細胞系譜解析によるパーシスタンスの理解と制御(課題番号:JPMJCR1927、研究代表者:若本祐一)」、JST CREST「光の特性を活用した生命機能の時空間制御技術の開発と応用(研究総括:影山龍一郎)」における「ゲノムの光操作技術の開発と生命現象解明への応用(課題番号:JPMJCR1653、研究代表者:佐藤守俊)」、科研費「多様な選択圧下での大腸菌進化実験による揺らぎ-応答関係の定量解析(課題番号:17H06389)」、「細胞複製能の階層横断的理解(課題番号:19H03216)」、特別研究員奨励費「一細胞計測と光遺伝子操作を利用した遺伝型-表現型対応の履歴依存性の理解(課題番号:JP19J22506)」及び地方独立行政法人 神奈川県立産業技術総合研究所の支援により実施されました。
問い合わせ先
<研究に関すること>東京大学 大学院総合文化研究科
教授 若本 祐一(わかもと ゆういち)
<JST事業に関すること>
科学技術振興機構 研究プロジェクト推進部 ICT/ライフイノベーショングループ
今林 文枝(いまばやし ふみえ)
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:eratowww(末尾に"@jst.go.jp"をつけてください)
<報道担当>
東京大学 教養学部等総務課 広報・情報企画チーム
E-mail:koho-jyoho.c(末尾に"@gs.mail.u-tokyo.ac.jp"をつけてください)
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:jstkoho(末尾に"@jst.go.jp"をつけてください)
用語解説
(注1)遺伝子型
細胞の遺伝的構成。ここでは、遺伝情報を担うDNAの配列のこと。
(注2)表現型
細胞が示す形質。例えば、細胞の大きさや形、増殖速度、薬剤に対する耐性度など細胞に対して評価・観察できる特徴は表現型と呼ぶことができる。ここでは、大腸菌細胞から生存に重要な遺伝子を欠損させた結果、細胞が示す特徴のこと。
(注3)Cre組換えタンパク質
特定の短いDNA配列を認識してDNA組換えを触媒するバクテリオファージ由来のタンパク質。
(注4)クロラムフェニコール
リボソームを標的としてタンパク質合成を阻害することにより、バクテリアの増殖を阻止する抗生物質。
(注5)リボソーム
タンパク質合成を担う生体分子。クロラムフェニコールの標的分子。大サブユニットと小サブユニットという2つの構造体から構成され、これらでメッセンジャーRNAをはさみ、タンパク質合成を触媒する。
論文情報
Yuta Koganezawa, Miki Umetani, Moritoshi Sato, Yuichi Wakamoto*, "History-Dependent Physiological Adaptation to Lethal Genetic Modification under Antibiotic Exposure," eLife: 2022年5月10日, doi:10.7554/eLife.74486.
論文へのリンク (掲載誌 )
)





