ゲノム編集を制御する新たな技術 ーSplit-CRISPR-Cpf1の開発ー 研究成果
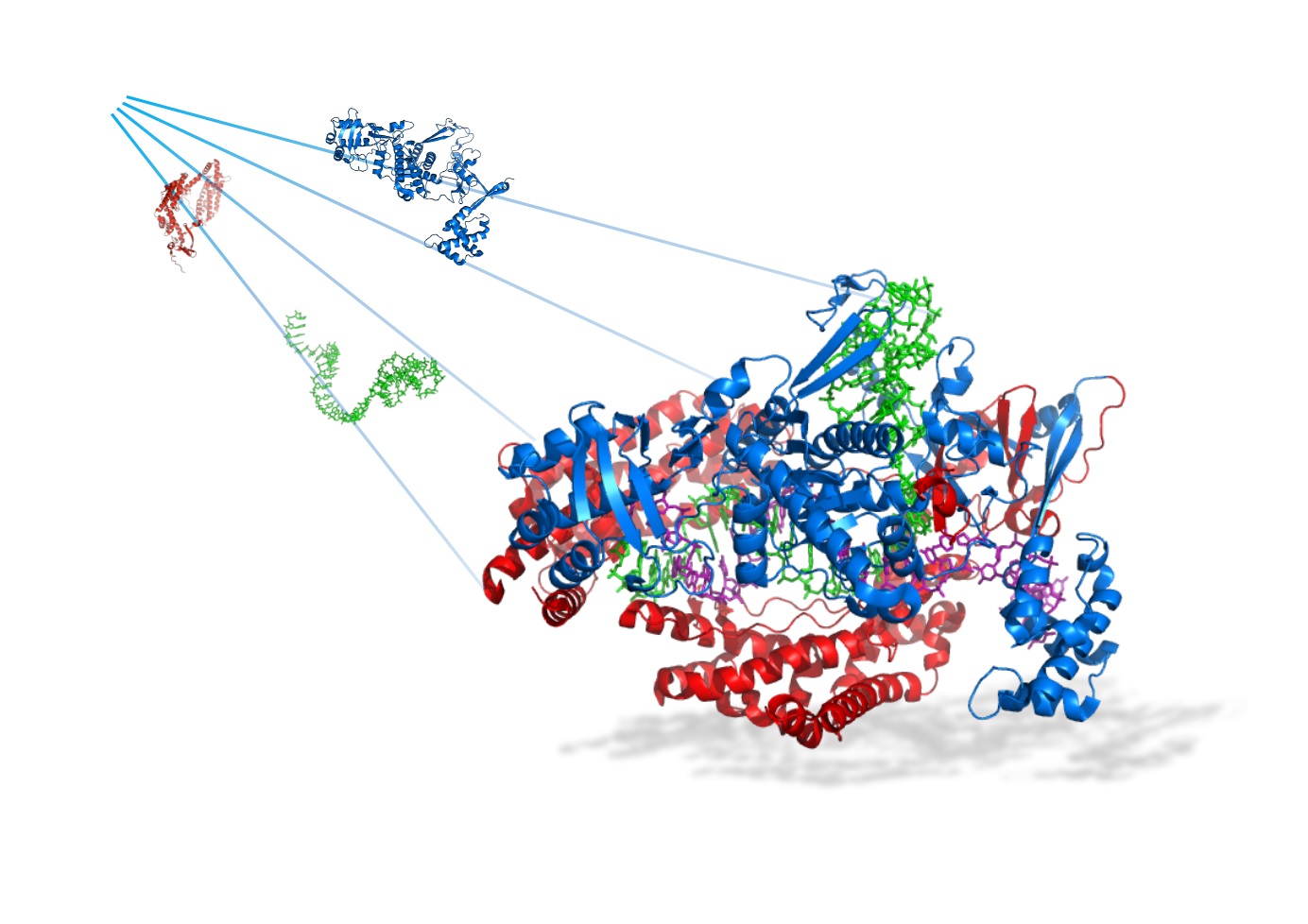
東京大学大学院総合文化研究科の二本垣裕太大学院生(現ジョンズホプキンズ大学医学部細胞生物学科 博士研究員)、小田部尭広特任研究員、佐藤守俊教授らの研究グループは、Cpf1タンパク質を二分割して得た分割体(split-Cpf1)に基づいて、ゲノム(遺伝子)編集を光によって制御したり、より効率的に遺伝子を発現したりできるツールを開発することに成功しました。
近年報告されたCRISPR–Cpf1(注1)は、従来技術のCRISPR–Cas9(注2)よりも標的DNAへの特異性が高いため、オフターゲット効果(注3)が小さく精度の高いゲノムエンジニアリング技術になると期待されています。しかし、Cpf1の分子構造がCas9とは大きく異なるため、Cas9を基に開発されてきた応用技術が、そのままではCpf1に適用できないという問題がありました。本研究では、この問題を解決するためにCpf1を分割してsplit-Cpf1を開発し、光刺激による精度の高いゲノム編集や極めて高い効率での遺伝子発現制御を実現しました。Split-Cpf1を基盤として、生体でのゲノムエンジニアリング(注4)がさらに発展することが期待されます。
本研究成果は、米国科学誌「Nature Chemical Biology」(電子版:英国時間8月12日)に掲載されました。
本研究成果は、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業(CREST)「光の特性を利用した生命機能の時空間制御技術の開発と応用」(研究総括:影山龍一郎 京都大学ウイルス・再生医科学研究所 教授)における「ゲノムの光操作技術の開発と生命現象解明への応用」(研究代表者:佐藤守俊 教授)および同大学発新産業創出プログラム(START、注5)「CRISPR–Cas9システムを光制御するゲノムエンジニアリングツール」(研究代表者:佐藤守俊 教授)の一環として得られました。
用語解説:
(注1)CRISPR–Cpf1 :ゲノムの切断を人為的に行うための技術。Cpf1と呼ばれるDNA切断酵素がガイドRNAとともにDNAに結合し、そのDNA配列を部位特異的に切断します。このCRISPR-Cpf1システムは、バクテリオファージに対する原核生物の免疫システムとして発見されました。CRISPR-Cas9と同様にゲノム編集に利用されています。
(注2)CRISPR–Cas9 :ゲノムの切断を人為的に行うための技術。Cas9と呼ばれるDNA切断酵素がガイドRNAとともにDNAに結合し、そのDNA配列を部位特異的に切断します。このCRISPR–Cas9システムは、バクテリオファージに対する原核生物の免疫システムとして発見されましたが、2012年以降、ゲノム編集に利用されています。
(注3)オフターゲット効果:本来の標的とする配列以外の類似配列を認識してしまい、意図しない変異が生じてしまうこと。
(注4)ゲノムエンジニアリング:ゲノム上の遺伝子の塩基配列を改変してその機能を破壊したり(ノックアウト)、別の塩基配列で置き換える(ノックイン)技術や遺伝子発現の亢進・抑制したり、特定の遺伝子を書き換える技術のこと。
(注5)大学発新産業創出プログラム(START:Program for Creating STart-ups from Advanced Research and Technology):詳細は「詳しい内容はこちら(PDF)」内の用語解説をご確認ください。
論文情報
Yuta Nihongaki, Takahiro Otabe, Yoshibumi Ueda, Moritoshi Sato*, "A split CRISPR–Cpf1 platform for inducible genome editing and gene activation," Nature Chemical Biology: 2019年8月13日, doi:10.1038/s41589-019-0338-y.






