核と細胞質間の分子輸送経路の破綻が筋萎縮性側索硬化症に関与 神経細胞死に至らしめる分子機構の一端を解明

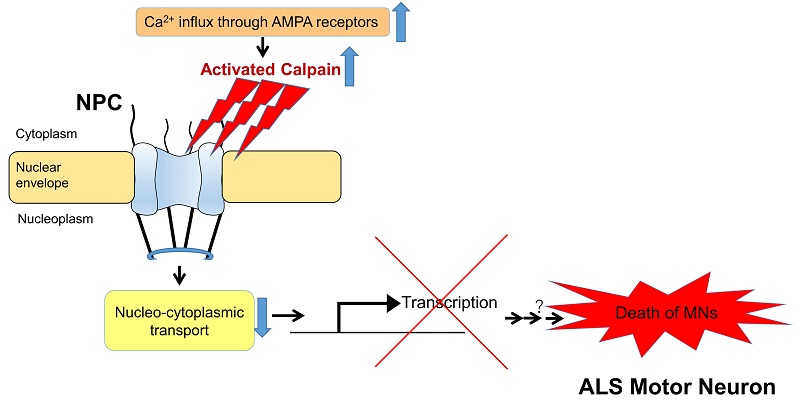
ALSにおいて、運動ニューロンで起こる核膜孔複合体を介した細胞死に至るまでの分子機構
孤発性ALSのモデルマウスの脊髄運動ニューロンでは、活性化されたカルパインが核膜孔複合体(NPC)を構成するヌクレオポリンタンパク質を切断し、核と細胞質の輸送を障害する。その障害によりニューロンの遺伝子の発現が抑えられ、生理機能が妨げられ、ニューロンが細胞死に陥ることが示唆された。
© 2017 Takenari Yamashita.
東京大学大学院医学系研究科の郭伸客員研究員(国際医療福祉大学特任教授)と山下雄也特任研究員らの研究グループは、遺伝的ではない孤発性筋萎縮性側索硬化症(ALS)の発症を促す仕組みの一端を、マウスを用いた実験により明らかにし、カルパインと呼ばれるタンパク質分解酵素が、核と細胞質の間で必要不可欠な分子を運ぶ通路を破壊することによって、神経細胞死が引き起こされることを示しました。本成果によって、ALS発症の理解がいっそう深まると期待されます。
研究グループは、ALSの発症の仕組みとして、まず、通常はカルシウムを取り込まない細胞膜中のタンパク質であるAMPA受容体が、過度にカルシウムを取り込んでしまう異常型に替えられ、骨格筋などを司る運動ニューロンに発現し、ニューロン内に過剰にカルシウムが流入すること、これによって、カルパインが過剰に活性化し、ALSに特徴的なTDP-43タンパクの細胞内局在の異常(TDP-43病理)を引き起こしていることを、これまで明らかにしていました。しかし、そこから運動ニューロンが死に至る仕組みの多くは分かっていませんでした。
研究グループは、今回、カルパインが異常に活性化することによって、RNAや蛋白質を核から細胞質へ運ぶ通路核膜孔複合体(NPC)を破壊していることをALSの症状や病理像を再現するマウスを用いて見出しました。具体的には、カルパインは核膜孔複合体を構成するヌクレオポリンタンパクを切断して、核と細胞質の間の物質輸送を損なっていました。そして、核と細胞質の輸送が障害されると、運動ニューロンにおいて必要な遺伝子の発現が抑えられ、運動ニューロンの生理活動が妨げられることで細胞死に陥ることが示唆されました。同様の変化がALSの患者の組織でも観察されたことから、今回の発見はALSの発症の仕組みに深く関連している可能性が高いと考えられます。
また、遺伝的に異常のあるALS患者(家族性ALS)の一部において、ALSが発症する仕組みにも核と細胞質の輸送の障害が報告されているため、原因は異なっていても類似した仕組みによってALSが引き起こされている可能性があります。
「この研究は、これまでグループとしては20年以上、私個人は10年以上にわたり続けてきたものです。今回の成果によって、遺伝しない孤発性ALSの運動ニューロンが細胞死に至る分子機構の一端が明らかになり、神経細胞死に直結したメカニズムの理解にさらに近づいたと考えています」と山下特任研究員は話します。「孤発性、家族性を問わず、ALSの発症の仕組みに共通した分子機構が見えてきたことも、孤発性ALS向けに開発している治療法がより広く適用できる可能性を示しており、感慨深いです」と続けます。
本研究は、東京医科大学の相澤仁志教授と共同で行われたものです。
論文情報
, "Calpain-dependent disruption of nucleo-cytoplasmic transport in ALS motor neurons", Scientific Reports Online Edition: 2017/01/03 (Japan time), doi:10.1038/srep39994.
論文へのリンク(掲載誌、UTokyo Repository)






