脂肪細胞に変化するのを防ぐ新規のクロマチン構造 脂肪を蓄える遺伝子の働きを抑えるクロマチン構造

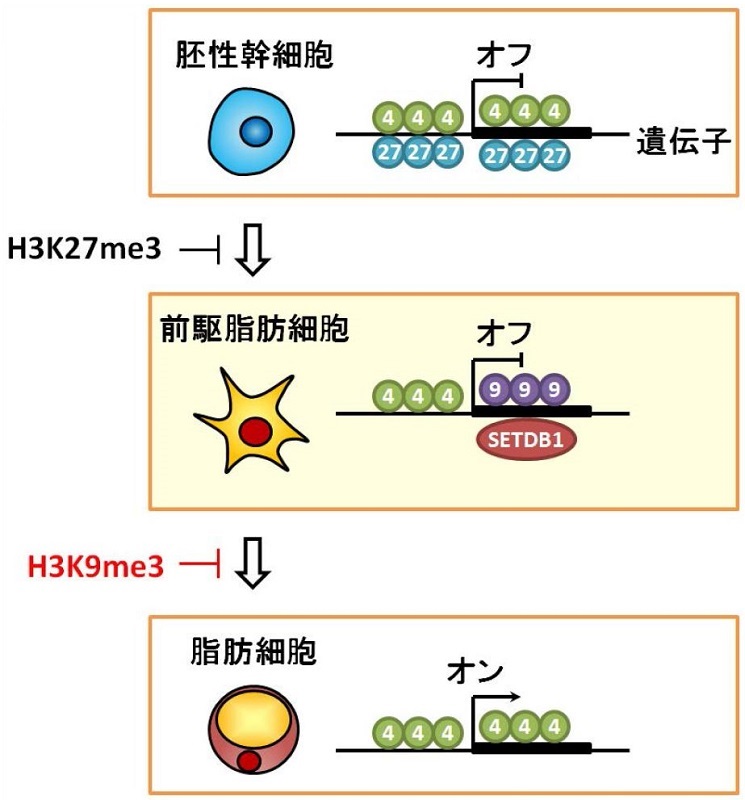
前駆細胞から脂肪細胞に変化するのを防ぐエピゲノムのしくみ
胚性幹細胞ではエピゲノムH3K27me3が脂肪を蓄える遺伝子の働きを抑えるのに対し、前駆脂肪細胞ではエピゲノムH3K9me3が遺伝子の働きを抑える。図の中の数値はトリメチル化されているヒストンH3タンパク質のリジンアミノ酸の番号を表わしている。
© 2015 酒井研究室
東京大学先端科学技術研究センターの酒井寿郎教授、松村欣宏助教らの研究グループは、脂肪細胞に変化する前の前駆脂肪細胞と呼ばれる細胞について、ゲノム以外の後天的に書き換えられる遺伝情報を解析し、新規のクロマチン構造が脂肪を蓄える遺伝子の働きを抑えていることを解明しました。本成果は、生活習慣病の予防や新規治療法につながることが期待されます。
私たち体の中にはメタボリックシンドロームの発症に重要な役割を果たす脂肪細胞と脂肪細胞になる前の前駆脂肪細胞が存在します。過剰に栄養を取ると、脂肪細胞は肥大化し、前駆脂肪細胞から脂肪細胞が誘導されて、余分なエネルギーが脂肪として脂肪細胞に蓄えられます。
前駆脂肪細胞も脂肪細胞もゲノムの塩基配列は同じですが、前駆脂肪細胞では脂肪を蓄える遺伝子の働きが抑えられ、脂肪細胞では遺伝子の働きが活発になっています。遺伝子の働きがそれぞれの細胞で異なるのは、エピゲノムとよばれる後天的に書き換えられるゲノム情報が異なるからです。しかし、前駆脂肪細胞に変化する前の胚性幹細胞では、遺伝子の働きを抑えるエピゲノムのしくみは知られていましたが、前駆脂肪細胞のものは明らかではありませんでした。
今回研究グループは、前駆脂肪細胞の遺伝子の働きを抑えるエピゲノム構造として、H3K9me3(ヒストンH3の9番目のリジンのトリメチル化)に着目し、エピゲノムH3K9me3およびそれに関わるタンパク質SETDB1がゲノム上の遺伝子配列のどこに存在するかを、次世代シークエンサーを用いて全ゲノム領域を解析しました。その結果、前駆脂肪細胞では遺伝子を活性化するH3K4me3(ヒストンH3の4番目のリジンのトリメチル化)と抑制化するH3K9me3が直列したクロマチン構造が約200の遺伝子に存在することがわかりました。そして、この新規のクロマチン構造が脂肪を蓄える遺伝子の働きを抑えていることを解明しました。
「これまで、胚性幹細胞では遺伝子の抑制化にエピゲノムH3K27me3が関与していることが知られていました」と酒井教授は話します。「今回、前駆脂肪細胞で新しいエピゲノムH3K9me3が見つかり、この構造は、神経細胞、皮膚細胞など他の前駆細胞にもある可能性があるため、今後の展開が期待されます」。
プレスリリース [PDF]
論文情報
, "H3K4/H3K9me3 Bivalent Chromatin Domains Targeted by Lineage-specific DNA Methylation Pauses Adipocyte Differentiation", Molecular Cell 60(4), 584-596: 2015/11/20 (Japan time), doi:10.1016/j.molcel.2015.10.025.
論文へのリンク(掲載誌)






