変則的な暗号を解読するためのはじめの一歩 ミトコンドリアゲノムの解読に必須なメチル化酵素を同定

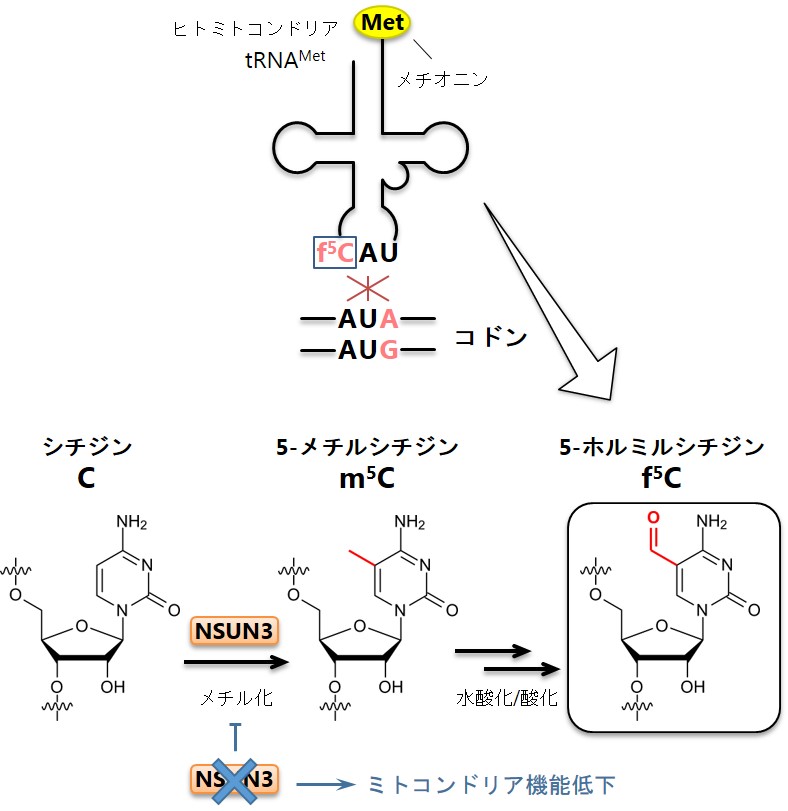
ヒトのミトコンドリア内でメチオニンを運ぶtRNA(tRNAMet)と5-ホルミルシチジン(f5C)修飾
(図上)ミトコンドリアtRNAMetはアンチコドンにf5C修飾を持つことで、通常のAUGコドンに加え、変則的にAUAコドンもメチオニンとして読み取ることができる。(図下)予想されるf5C修飾の生合成機構。はじめに、今回特定したNSUN3タンパク質がシチジン(C)をメチル化することで5-メチルシチジン(m5C)を形成する。次に未知の酵素によるm5Cが水酸化および酸化され、f5Cが作られる。NSUN3タンパク質を欠損するとf5C修飾が消失し、AUAコドンが読めないことでミトコンドリアの機能が低下する。
© 2016 Tsutomu Suzuki
東京大学大学院工学系研究科化学生命工学専攻の中野沙緒里大学院生(当時)、鈴木健夫講師、鈴木勉教授らの研究グループは、ヒトのミトコンドリア内で、通常とは異なる様式で遺伝暗号を解読するのに必須なトランスファーRNA(tRNA)を修飾する酵素を発見し、この酵素と修飾の欠損が、ミトコンドリアの機能異常を引き起こし、疾患の原因になりうることを示しました。
ミトコンドリアは細胞が使うエネルギーを生産する細胞内小器官であり、ヒトや動物が生きていく上でとても重要な役割を担っています。ミトコンドリアには独自のゲノムがあり、このゲノムを鋳型としてミトコンドリア内でタンパク質が合成されます。この過程で、tRNAはアンチコドンと呼ばれる部位で、3つの塩基配列を一つのかたまり(コドン)として認識して、タンパク質の合成に必要なアミノ酸をタンパク質が合成されている場所に運びます。
しかし、細胞内で行われる通常のタンパク質合成においては、アデニン-ウラシル‐アデニン(AUA)のコドンは、イソロイシンというアミノ酸を運ぶtRNAに認識されるところ、ヒトのミトコンドリア内ではメチオニンを運ぶtRNAに認識される特徴があります。この通常とは異なる様式には、アミノ酸を運ぶtRNAのゲノム情報を読み取るアンチコドンに5-ホルミルシチジンという修飾塩基が必要であることが知られています。しかし、これまでの研究では、5-ホルミルシチジンがどのように生合成され、この修飾が細胞や個体レベルでどのような生理機能を持つかについては未解明でした。
研究グループは、NSUN3遺伝子を欠いたヒトの細胞のtRNAでは5-ホルミルシチジン修飾が見られないことを突き止めました。実際にこのようなヒトの細胞ではミトコンドリアの様々な機能が低下していました。NSUN3タンパク質はtRNAのアンチコドンをメチル化する酵素であると判明し、このメチル化からさらに酸化する未知の酵素により5-ホルミルシチジンへ変換されることが示唆されました。
また、メチオニンを運ぶtRNAの遺伝子上の変異は、ミトコンドリア機能異常疾患の原因として報告されていますが、これらの中の2つの変異は、NSUN3タンパク質による5-メチルシチジンの形成効率を大きく低下させることを見出しました。
「大変な研究でしたが、ヒトが健康に生きていくためにはきっと5-ホルミルシチジン修飾が重要で、欠くと病気に関わるかもしれないと想うことで、モティベーションを切らさずに研究を続けられました」と中野大学院生は話します。「遺伝子を欠いた細胞の解析で5-ホルミルシチジン修飾が欠損していることがわかったときは、大喜びしたのを昨日のことのように覚えています」。
「5-ホルミルシチジン修飾は発見されてから、20年以上経ちますが、その生理的な役割や生合成は全く不明であり、挑戦しがいのある研究対象でした」と鈴木講師は説明します。「今回明らかになったのは、ミトコンドリア内の変則的な暗号解読が必要とする最初のステップですので、今後はメチル化以降の仕組みを解き明かすことも必要です。5-ホルミルシチジン修飾の欠損はヒトの疾患に関わることから、将来的にこの研究が創薬や医療の分野で役に立てればと思います」と今後の展開に大きな期待を寄せます。
論文情報
, "NSUN3 methylase initiates 5-formylcytidine biogenesis in human mitochondrial tRNAMet", Nature Chemical Biology: 2016/5/24 (Japan time), doi:10.1038/nchembio.2099.
論文へのリンク(掲載誌)






