新規光駆動型イオンチャネルの構造解明と高性能分子ツールの創出~神経科学に光を当てる~研究成果

掲載日:2022年2月3日
発表者
岸 孝一郎(東京大学 大学院総合文化研究科 広域科学専攻 修士課程2年)
Yoon Seok Kim(Postdoctoral fellow, Department of Bioengineering, Stanford University)
福田 昌弘(東京大学 大学院総合文化研究科 附属先進科学研究機構 特任助教)
井上 昌俊(Postdoctoral fellow, Department of Bioengineering, Stanford University)
草木迫 司(東京大学 大学院理学系研究科 生物科学専攻 助教)
Peter Wang(Postdoctoral fellow, Department of Bioengineering, Stanford University)
野村 紀通(京都大学 大学院医学研究科 准教授)
岩田 想(京都大学 大学院医学研究科 教授)
井上 圭一(東京大学 物性研究所 准教授)
Karl Deisseroth(Professor, Department of Bioengineering, Stanford University)
加藤 英明(東京大学 大学院総合文化研究科 広域科学専攻・附属先進科学研究機構 准教授)
発表のポイント
- 光刺激によって陽イオンを輸送するタンパク質、チャネルロドプシン(注1、2)の中でも近年特に注目されているChRmine(注3)について、クライオ電子顕微鏡(注4)を用いてその立体構造を決定し、ChRmineがイオンチャネルとして機能する仕組みを明らかにしました。
- 得られた立体構造の知見を利用して、自然界には存在しない改変型ChRmineを作製し、分子ツールとして用いることでより発展的な光遺伝学実験(注5)を可能にしました。
- 本研究により、チャネルロドプシンのイオン輸送メカニズムの多様性への理解が深まり、さらに開発した改変型ChRmineは光遺伝学を通じて神経科学や医療への発展に貢献することが期待されます。
発表概要
光遺伝学は特定の神経細胞の活動を「光」によって制御する革新的技術であり、今や神経科学において必須の技術となっています。光遺伝学には光受容タンパク質であるチャネルロドプシンがツールとして利用されており、日々新規の光遺伝学ツールが発見、改良されています。近年自然界から発見されたチャネルロドプシンであるChRmineは、高いイオン電流、高い光感受性、長波長光によって活性化されるという光遺伝学ツールとして非常に強力な性能を有しているだけでなく、機能はチャネルロドプシンであるにも関わらず、アミノ酸配列はポンプ型ロドプシン(注6)と近いという興味深い特徴を有していました。しかしChRmineがなぜイオンチャネルとして働くことができるのかは不明でした。
今回、東京大学大学院総合文化研究科の岸孝一郎、加藤英明准教授らのグループは、クライオ電子顕微鏡を用いてChRmineの立体構造を決定することに成功しました。その結果、ChRmineは大域的にはポンプ型と良く似ている一方、局所的には従来のポンプ型、チャネル型には見られない構造的特徴を複数有しており、このことがChRmineのユニークな分子機能の決定に寄与しているということがわかりました。さらに得られた立体構造の知見から、長波長光によって活性化されるというChRmineの性質をさらに向上させた改変型ChRmineを開発し、3色の可視光を利用して複数の神経細胞集団を同時に光操作・計測するという、より発展的な光遺伝学実験を可能にしました。
本研究成果は、多様なチャネルロドプシンがイオンチャネルとして機能する仕組みに対する理解を深めたというだけでなく、新規ロドプシンの設計や創製に対する道標、そして神経科学分野へ強力なツールを提供したという点で、神経科学、医療の発展につながることが期待されます。
本研究成果は、2022年2月2日(米国東部標準時)に米国科学誌「Cell」のオンライン版に掲載されました。
発表内容
研究の背景
ヒトから微生物まで多くの生き物は光受容タンパク質を介して光を受け取り、そこから情報やエネルギーを受け取っています。光受容タンパク質の中でも微生物が有するイオンポンプやイオンチャネルとして働く「イオン輸送型ロドプシン」は、光エネルギーをイオン輸送という仕事に変換する精巧な分子装置です。この性質が着目され、イオン輸送型ロドプシンは特定の神経細胞の活動を光により制御可能な実験ツールとして利用されるようになり、神経科学において必須の技術(光遺伝学)となりました。しかし、これまで光遺伝学ツールとして用いられてきたチャネルロドプシンは光電流が弱い、光感受性が低い、短波長光(青色)での光でしか活性化できないといった問題点を抱えていました。近年自然界から発見されたチャネルロドプシンであるChRmineは、高いイオン電流、高い光感受性、長波長光(赤色光)によって活性化されるという、光遺伝学ツールとして非常に強力な性能を有しています。さらにアミノ酸配列に基づく系統解析から、機能はチャネルロドプシンであるにも関わらず、アミノ酸配列はポンプ型ロドプシンと近いという興味深い特徴を有することがわかっていました(図1)。しかし「ChRmineとポンプ型ロドプシンはどの程度似ているのか」、「似ているとしたらなぜChRmineはイオンチャネルとして働くことができるのか」、また「ChRmineの性質をさらに向上させた光遺伝学ツールを作ることができるのか」といった疑問が残されていました。
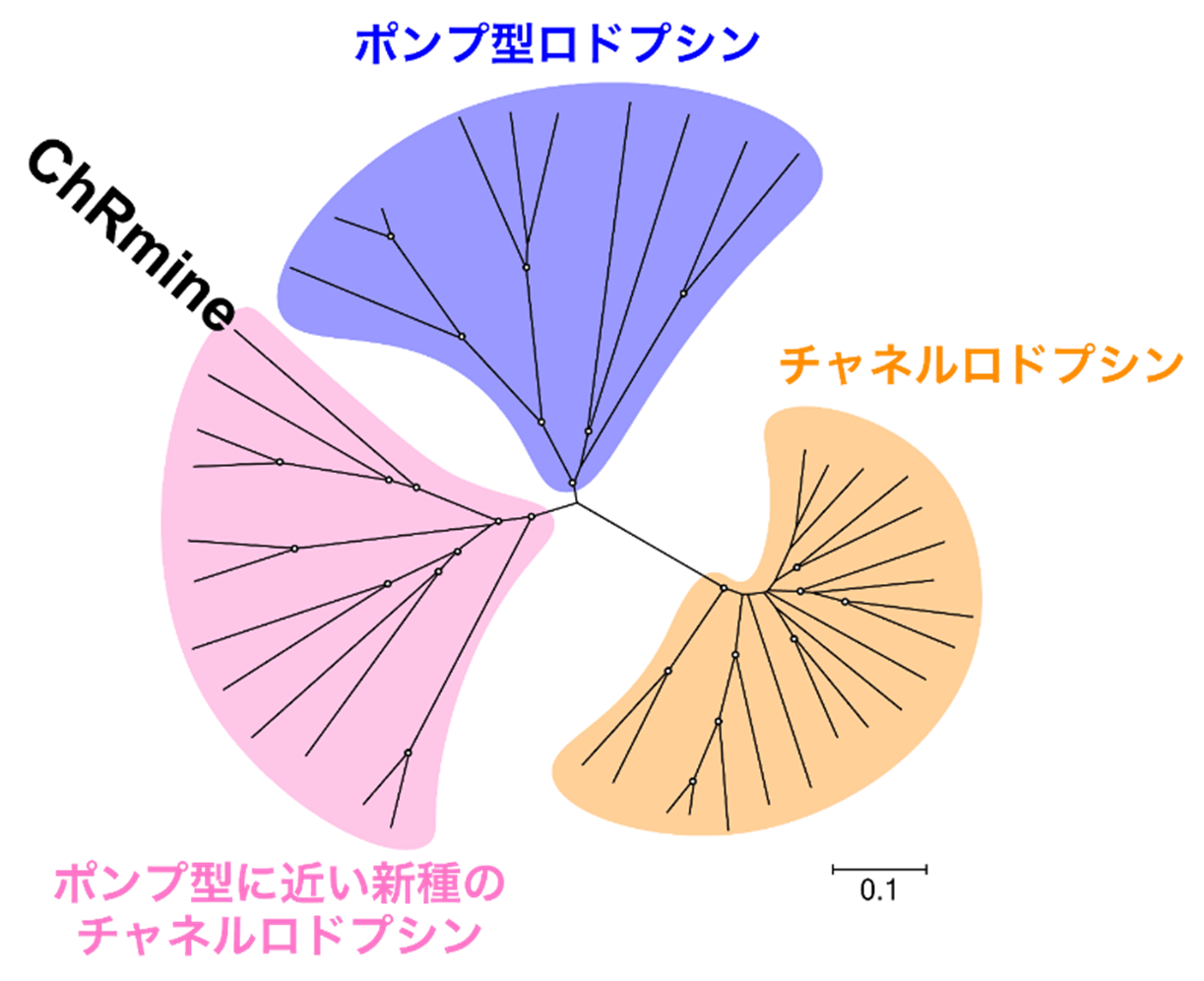
研究内容
今回、東京大学大学院総合文化研究科の加藤英明准教授を中心とする研究グループは、クライオ電子顕微鏡を用いてChRmineの立体構造を2.0 Å分解能(注7)という非常に高解像度で決定することに成功しました。その結果、ChRmineは3量体を形成しており、2量体を形成することで機能する従来のチャネルロドプシンよりも、3量体を形成するポンプ型と似ていることがわかりました(図2)。さらに単量体同士で構造を比較してみると、ChRmineは従来の2量体型チャネルロドプシンよりも、ポンプ型ロドプシンと似ていることがわかりました(図3A)。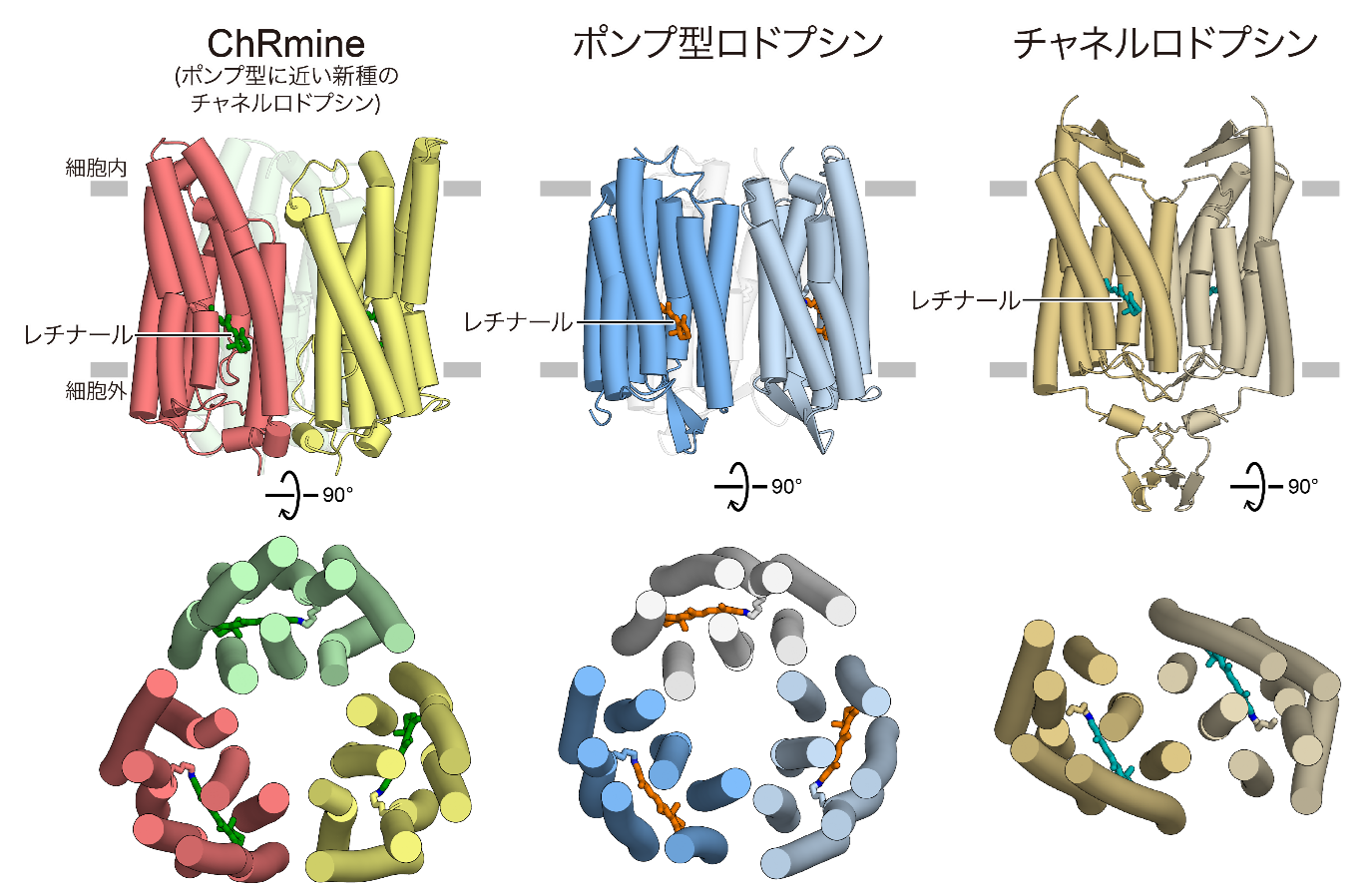
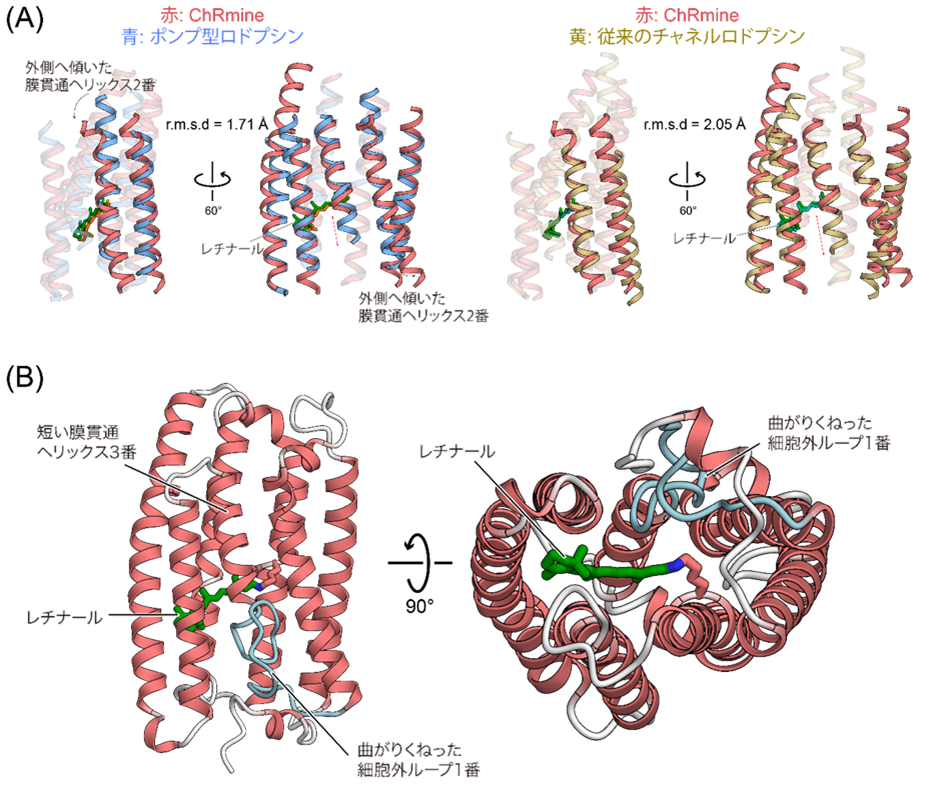
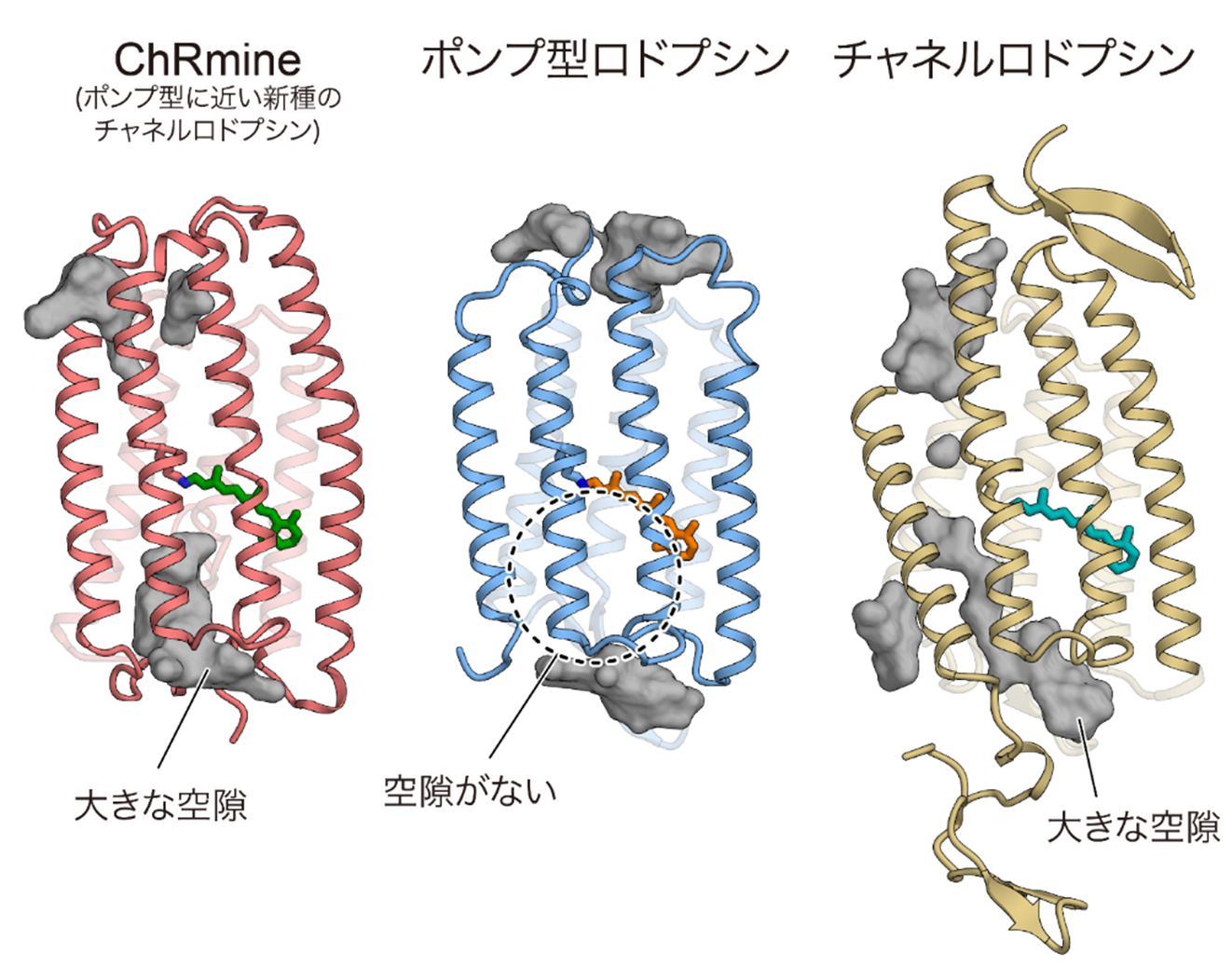
続いて「なぜChRmineはポンプ型と類似の構造を持ちながらイオンチャネルとして働くことができるのか」という問いに答えるため、単量体の構造を注意深く観察しました。するとChRmineはポンプ型ロドプシンと比較して、(1) 2番目の膜貫通ヘリックスが細胞内外で外側に倒れていること、(2) 3番目の膜貫通ヘリックスが膜の途中でほどけていたこと、(3) 1つ目の細胞外ループが長く、そして曲がりくねっていたことが明らかとなりました(図3B)。その結果として、ChRmineは細胞内外にイオンが透過するための大きな空隙を持つことがわかりました(図4)。イオンを一つずつ輸送するポンプ型は単量体内に空隙を持たない一方、これまで構造が明らかにされてきたチャネルロドプシンは、すべて単量体内にイオン透過路として働く空隙を持つことから、空隙を持つことはChRmineがチャネルとして機能するために重要であることが示されました。
続いて構造から得られた知見を利用して「ChRmineの性質をさらに向上させた光遺伝学ツールを作ること」を目指して、ChRmineの長波長光(赤色光)によって活性化されるという特徴に着目しました。そして本研究グループは、光を吸収する部位周辺のアミノ酸残基を改変することで、より長波長側(赤側)の光によって活性化可能なrsChRmine(red-shiftedの意)を含む、3種のChRmine改変体(rsChRmine, hsChRmine(注8), frChRmine(注9))の作製に成功しました。さらにこのrsChRmineを用いることで、3色(青、黄、緑)の光を用いて、生きたマウス脳内で複数の神経細胞集団を同時に光操作・計測するという「3色光遺伝学実験」を世界で初めて成功させました(図5A)。最後に、rsChRmineは近赤外光(>740 nm)でも活性化可能な初のチャネルロドプシンであることを示し、rsChRmineの傑出した性能を実証しました(図5B)。
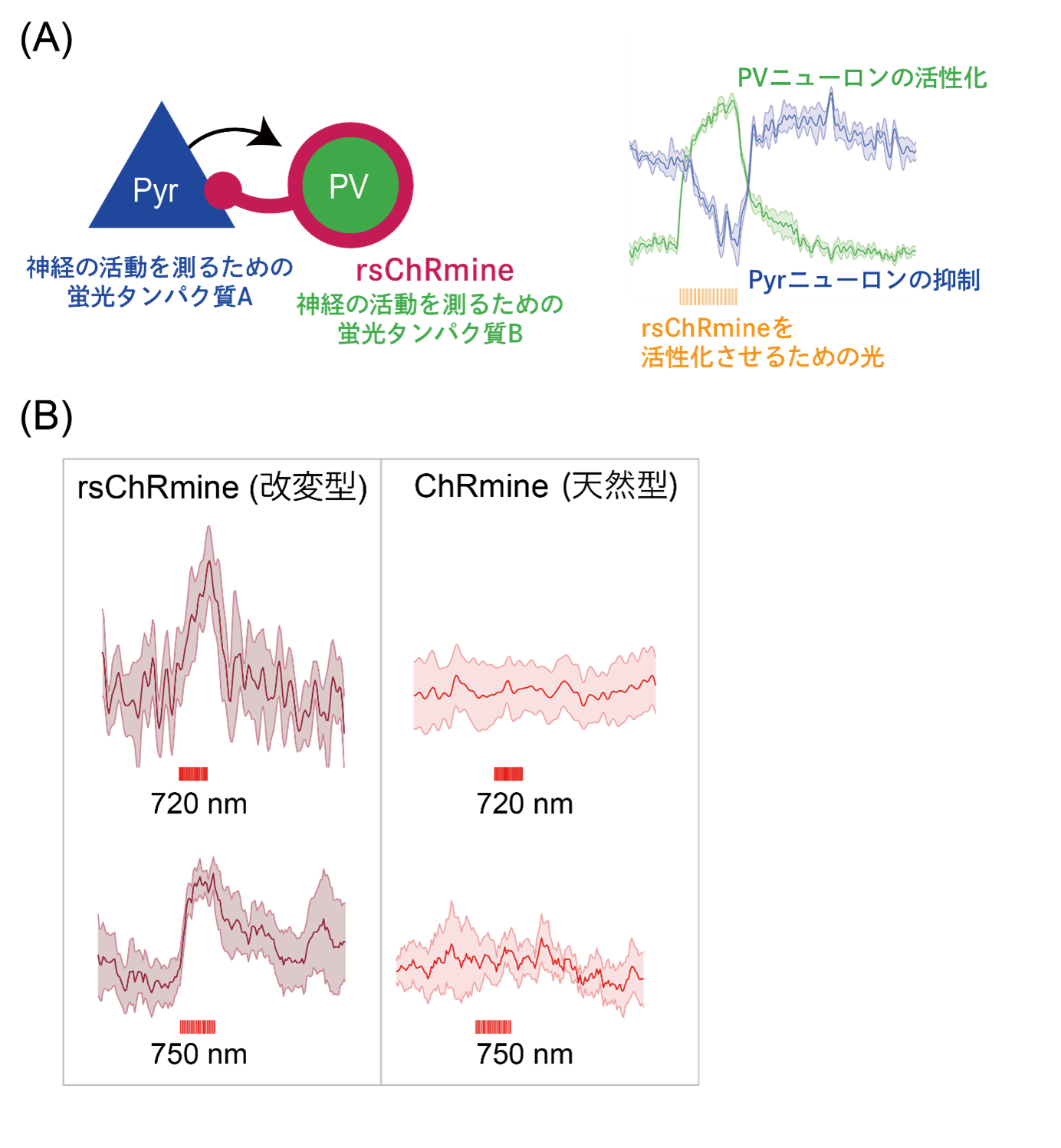
この実験では3つのタンパク質を用いている。1つ目はPVニューロンを活性化させるためのrsChRmine。2つ目はPyrニューロンの活動を測るための蛍光タンパク質A。そして3つ目はPyrニューロンに作用しているPVニューロンの活動を測るための蛍光タンパク質B。PVニューロンが活性化するとその刺激がPyrニューロンへ伝わり、Pyrニューロンが抑制される。(B) rsChRmineは720 nmや750 nmといった近赤外光でも活性化され、チャネルロドプシンの活性化波長の記録を大幅に塗り替えた。
今後の展開
本研究では「ポンプ型に近い新種のチャネルロドプシン」であるChRmineの立体構造を初めて明らかにしました。今回の結果は、多様なチャネルロドプシンのイオン透過機構に関する理解を促進させただけでなく、チャネルロドプシンの構造解析手法の幅を広げ、ロドプシンの分子進化を解明する上での新たな手掛かりを与えました。加えて本研究では、得られた構造情報を用い、ChRmineの持つ傑出した性能をさらに引き出した3種の改変体(rsChRmine, hsChRmine, frChRmine)を創出し、特にrsChRmineを利用することで新たな光遺伝学実験を可能にしました。これらのChRmine改変体は神経科学の研究を推進するだけではなく、眼精疾患に対する遺伝子治療応用などにも利用されることが期待されます。
本研究は主に、「JST 創発的研究支援事業(課題番号:JPMJFR204S)」、「JST CREST(課題番号:JPMJCR21P3)」、「JST さきがけ(課題番号:JPMJPR1782、JPMJPR1888)」「AMED-BINDS (課題番号:JP18am0101079)」「科学研究費助成事業(課題番号:JP20K21383、JP21H01875)」の支援により実施されました。
用語解説
(注1)ロドプシン
ヒトから微生物まで多くの生き物が持つ光受容タンパク質。7回膜貫通タンパク質であり、中心に光を吸収する低分子としてレチナールを結合している。
(注2)チャネルロドプシン
ロドプシンの中でもイオンの電気化学勾配に従ってイオンを輸送する「イオンチャネル」として機能するもの。2002年に藻類から発見された。
(注3)ChRmine(カーマイン)
2019年に自然界から発見された新規チャネルロドプシン。光遺伝学ツールとして優れた性能を持ち、「100以上の神経細胞を単一細胞レベルで同時に光操作・計測する全光型電気生理学」、「手術をおこなわず頭蓋骨越しに脳深部領域を活性化するファイバーフリー光遺伝学」といった数々の発展的光遺伝学実験を可能にし、また網膜色素変性症治療へ応用できる可能性も指摘されていることから、現在非常に注目を集めている。
(注4)クライオ電子顕微鏡
2017年にノーベル化学賞を受賞した技術。一般的な光学顕微鏡とは異なり、極低温環境(クライオ)でタンパク質サンプルに電子線を照射し、その投影像から立体構造を計算して求める手法。この手法によってタンパク質の構造解析にかかる時間が大幅に短縮され注目を集めている。
(注5)光遺伝学(オプトジェネティクス)
opto(光)とgenetics(遺伝学)を組み合わせた言葉であり、その意味の通り、遺伝学の手法を用いて特定の神経細胞に光受容タンパク質を発現させ、光によって神経細胞の活動を制御する技術。Stanford大学のKarl Deisseroth博士らによって提唱された。
(注6)ポンプ型ロドプシン
チャネルロドプシン(注2)とは対照的にイオンを細胞内外に一方向性に輸送するロドプシン。
(注7)分解能
解像度の指標。電子顕微鏡構造解析のクオリティを示す際に用いられ、値が小さいほど高解像度。2.0 Å分解能はチャネルロドプシン構造解析における最高分解能の一つ。
(注8)hsChRmine
ChRmineのオフキネティクス(光をオフにしてからチャネルが閉じるまでの速度)を早めた改変体。
(注9)frChRmine
rsChRmineに導入した変異とhsChRmineに導入した変異を掛け合わせた改変体。
(注10)r.m.s.d値
タンパク質構造の類似度の指標。値が小さいほど類似度が高い。
論文情報
Koichiro E. Kishi, Yoon Seok Kim, Masahiro Fukuda, Masatoshi Inoue, Tsukasa Kusakizako, Peter Y. Wang, Charu Ramakrishnan, Eamon F.X. Byrne, Elina Thadhani, Joseph M. Paggi, Toshiki E. Matsui, Keitaro Yamashita, Takashi Nagata, Masae Konno, Sean Quirin, Maisie Lo, Tyler Benster, Tomoko Uemura, Kehong Liu, Mikihiro Shibata, Norimichi Nomura, So Iwata, Osamu Nureki, Ron O. Dror, Keiichi Inoue, Karl Deisseroth, Hideaki E. Kato *, "Structural basis for channel conduction in the pump-like channelrhodopsin ChRmine," Cell: 2022年2月2日, doi:10.1016/j.cell.2022.01.007.
論文へのリンク (掲載誌 )
)
関連リンク
- 東京大学 大学院総合文化研究科・教養学部

- 東京大学 大学院理学系研究科・理学部

- 東京大学 物性研究所

- 京都大学 大学院医学研究科・医学部

- JST 創発的研究支援事業

- リリース文書 (PDFファイル: 1.7MB)





