栄養センサーTOR経路による新たな遺伝子発現制御メカニズムを発見研究成果

発表のポイント
- タンパク質を合成する装置「リボソーム」を作る遺伝子の発現スイッチが、栄養状態によって制御される新しい仕組みを見出しました。
- 細胞が飢餓状態になると、栄養状態を感知するTOR経路が不活性化し、リボソーム遺伝子領域に、RNA干渉に依存してヘテロクロマチンが形成されることを発見しました。
- TOR経路は、がんの発生や老化と密接に関連しており、今回明らかにした仕組みを応用することで、がん治療や寿命の延伸に貢献できる可能性があります。
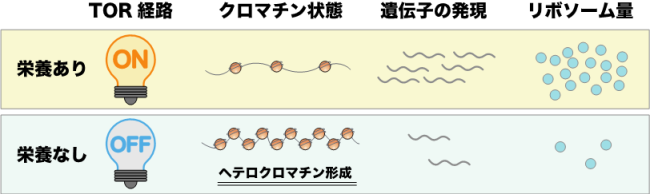
TOR経路の不活性化によってリボソーム遺伝子領域にヘテロクロマチンが形成されることを発見
発表概要
東京大学大学院総合文化研究科の平井隼人特任研究員、太田邦史教授らの研究グループは、分裂酵母細胞が栄養飢餓に直面すると、リボソーム(注1)に関連する遺伝子領域に、RNA干渉(注2)に依存したヘテロクロマチン(注3)と呼ばれる高度なクロマチン凝集体が形成され、遺伝子発現が抑制されることを発見しました。本研究グループはさらに、飢餓がどのようにしてヘテロクロマチン形成を引き起こすのか解析したところ、外部の栄養を感知するTOR(Target of Rapamycin: 注4)と呼ばれる経路の不活性化が契機となることを明らかにしました。
TORは免疫抑制作用、抗がん作用、寿命延長作用のあるラパマイシンの標的分子として知られているほか、リボソームの機能欠損はダイアモンド・ブラックファン貧血などのリボソーム病 (注5)をもたらし、ヒトのがんや造血異常に密接に関連しています。今後ヒト細胞においても解析を進めることで、がん治療や寿命の延伸に貢献できることが期待されます。
本研究成果は、米国Cell Press社が出版するCell Reports誌に掲載されました。
発表詳細
大学院総合文化研究科のページからご覧ください。
発表者
用語解説
(注1)リボソーム
生命の設計図であるDNAから転写されたメッセンジャーRNAをタンパク質へと変換する装置。様々なタンパク質を絶え間なく合成するため、細胞内には大量のリボソームが存在する。酵母では全RNAのうち約8割がリボソームを構成するrRNAが占めている。
(注2)RNA干渉
非コードRNAに由来する低分子二本鎖RNA(siRNA)が、相補的な配列をもつ領域にヘテロクロマチン関連因子を呼び込んで転写を抑制する仕組み。モデル生物として用いられる出芽酵母Saccharomyces cerevisiaeにはRNA干渉に関する因子が存在しない。
(注3)ヘテロクロマチン
DNAを細胞内の核にコンパクトに格納するため、DNAはヒストンとよばれるタンパク質に巻き付いてヌクレオソームを形成している。ヌクレオソームはさらに規則正しく折りたたまれることでクロマチン構造を形成する。ヘテロクロマチンは、クロマチンが高度に凝集して転写が抑制された状態を指す。
(注4)TOR
TOR(Target of Rapamycin)は抗腫瘍・免疫抑制剤であるラパマイシンの標的分子で、細胞成長や栄養シグナル伝達にとって重要な働きを持つ。TORには2種類の複合体が存在し、それぞれTORC1とTORC2がある。研究グループは今回、TORC1の不活性化がrDNA領域のヘテロクロマチン化を引き起こすことを明らかにした。
(注5)リボソーム病
ヒトの疾患のいくつかは、リボソームに関連する遺伝子に傷が入ることで発症する。このような疾患には、ダイアモンド・ブラックファン貧血や先天性角化不全症、T細胞急性リンパ性白血病などが含まれる。
論文情報
Hayato Hirai*, Yuki Sen, Miki Tamura, Kunihiro Ohta*(*共責任著者), "TOR Inactivation Triggers Heterochromatin Formation in rDNA during Glucose Starvation," Cell Reports: 2023年10月31日, doi:10.1016/j.celrep.2023.113320.
論文へのリンク (掲載誌 )
)





