動物モデルを用いた新型コロナウイルス半生ウイルスワクチンプラットフォームの確立研究成果

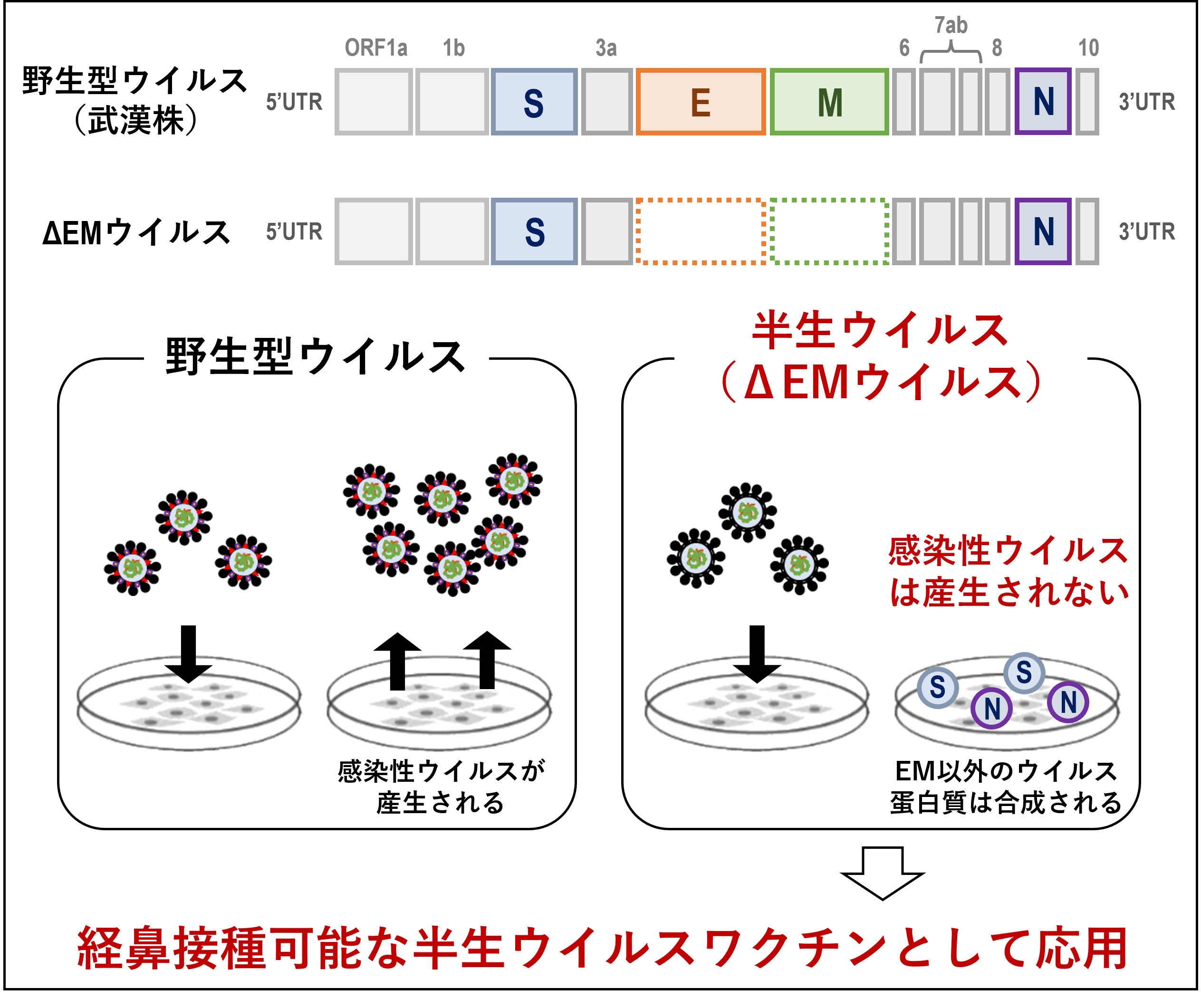
- ウイルス粒子を構成する4つの構造蛋白質のうち、EおよびMをコードする2つの遺伝子を欠損させたΔEMウイルスを作製した。
- このΔEMウイルスは感染性ウイルス粒子を産生しない半生ウイルスであり、経鼻接種可能な半生ウイルスワクチンとして応用した。
- ΔEMウイルスワクチンで誘導される免疫は、感染局所においてS蛋白質特異的IgA抗体、SおよびN蛋白質に対するT細胞応答を誘導し、起源株を基にしたワクチンであるにもかかわらず、抗原性が大きく変化したオミクロンXBB株に対しても、肺のみならず鼻でのウイルス増殖も抑制した。よって、本ワクチンは重症化を防ぐのみならず、ウイルスの伝播も抑制するワクチンとなり得ることが示された。
発表内容
東京大学 国際高等研究所 新世代感染症センター 河岡義裕 機構長らの研究グループは、感染性ウイルス粒子を産生しない新型コロナウイルス(ΔEMウイルス)を作製し、マウスモデル及びハムスターモデルを用いて、本ウイルスが半生ウイルスワクチン(注1)として有用であることを示しました。mRNAワクチンをはじめ、蛋白質サブユニットワクチン、ナノ粒子ワクチン、自己複製型mRNAワクチンなど様々なワクチンプラットフォームが、新型コロナウイルスの変異株だけでなく同じβコロナウイルス属に属する他のウイルスに対しても有効な汎コロナウイルスワクチンの開発に応用されています。新型コロナウイルス感染症に限らず、呼吸器感染症に対するワクチンには、感染局所で粘膜免疫を誘導すること、変異しやすいスパイク蛋白質に加えて他のウイルス蛋白質も標的とすること、さらに免疫効果が長期間持続することが求められています。
本研究では、そのようなワクチンプラットフォームの実現を目的として、実際の野生型ウイルス感染で得られる免疫と同様の免疫応答を誘導できる半生ウイルスワクチンの開発に取り組みました。
我々が作製したΔEMウイルスは、ウイルス粒子を構成する4つの構造蛋白質のうち、免疫原性に寄与するスパイク蛋白質Sとウイルス蛋白質合成に必須なヌクレオカプシド蛋白質Nは保持する一方で、ウイルス粒子の組み立てに関与するエンベロープ蛋白質Eとメンブレン蛋白質Mの遺伝子をウイルスゲノムから欠失させたウイルスです。このΔEMウイルスは、EM蛋白質を発現する細胞では野生型ウイルスと同様に増殖し、S蛋白質発現に伴う巨大な融合細胞の形成が観察されました(図1)。EM蛋白質発現細胞にΔEMウイルスを感染させると、感染後3日目には1x105 pfu/ml(注2)のウイルス力価が得られました。一方、EM蛋白質を発現しない野生型細胞では、ΔEMウイルスを感染させても細胞培養液中に感染性粒子は検出されず、融合細胞のみが確認されました。この結果は、ΔEMウイルスが半生ウイルスであることを示しており、ΔEMウイルスによって産生されるウイルス蛋白質が、中和抗体やT細胞免疫の抗原として提示されると考えられます。

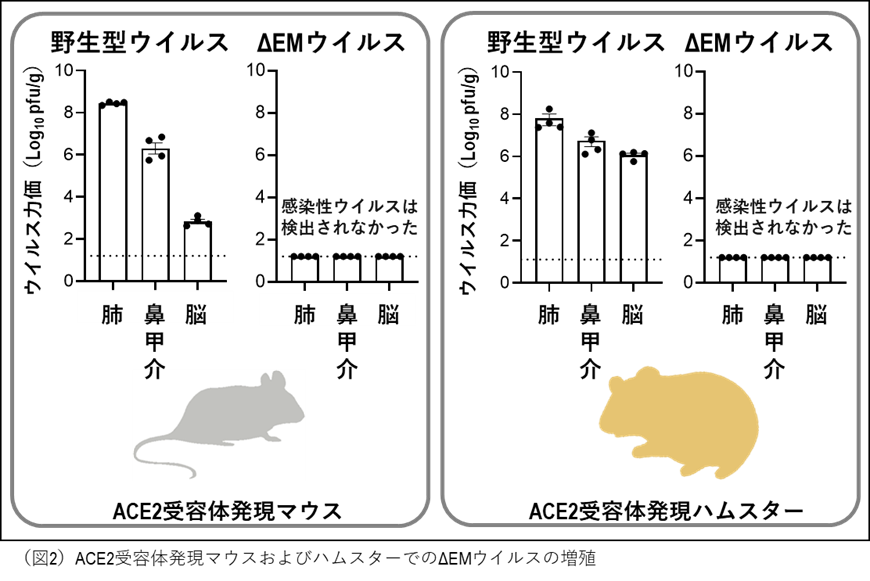
次に、動物体内でのΔEMウイルスの増殖および残存性を検討しました(図2)。新型コロナウイルス受容体であるACE2を全身に発現するマウスおよびハムスターにΔEMウイルスまたは野生型ウイルスを経鼻接種し、肺、鼻甲介、脳におけるウイルス力価を測定しました。野生型ウイルスでは、感染3日目に肺および鼻甲介から高力価のウイルスが検出され、脳への侵入も認められました。一方、ΔEMウイルス接種群では、いずれの臓器からもウイルスは検出されませんでした。この結果から、ΔEMウイルスは高感受性動物の体内においても、増殖しないことが確認されました。
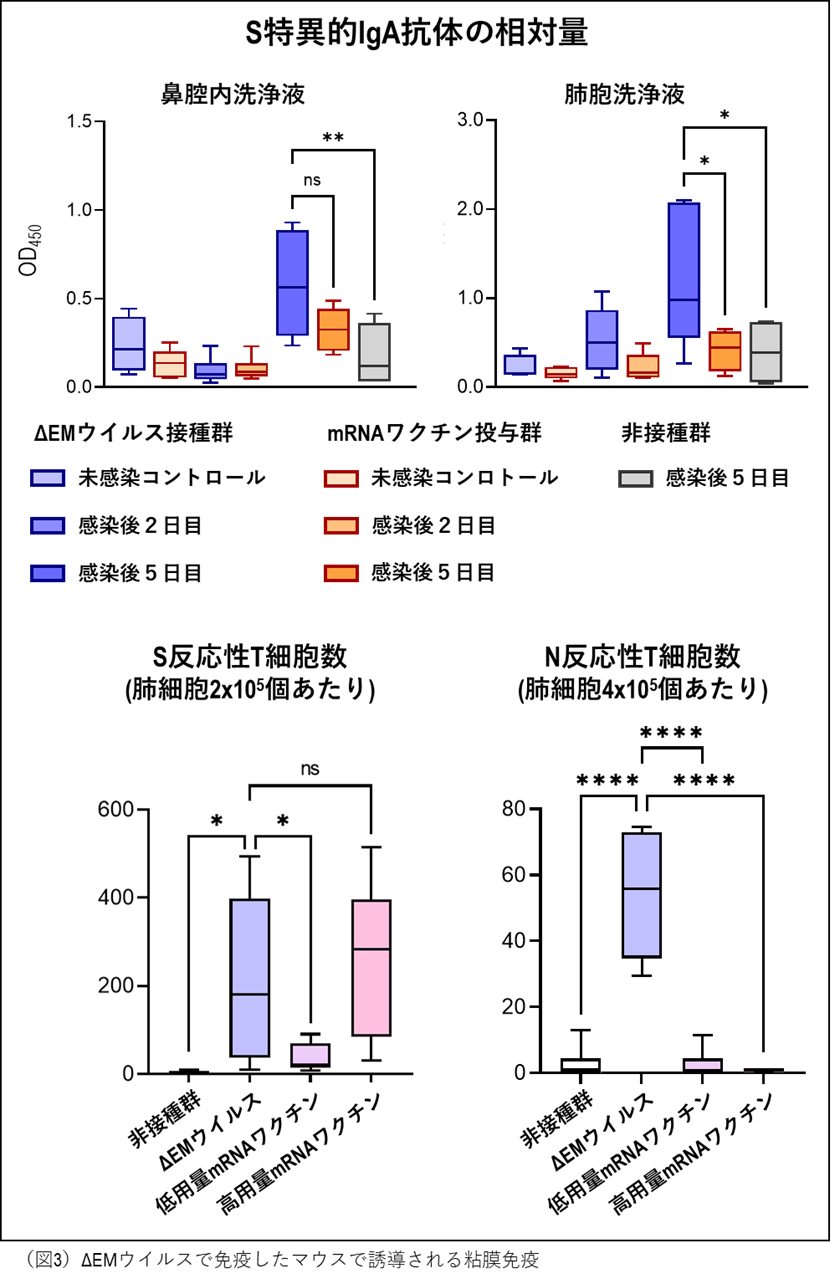
続いて、ACE2発現マウスモデルを用いて、ΔEMウイルス接種後(4週間後)に誘導されるS蛋白質特異的IgA抗体の産生を評価しました(図3)。ΔEMウイルス接種群では、野生型ウイルス感染後5日目の鼻腔洗浄液中において、非接種群と比較してIgA抗体価の有意な上昇が認められました。ただし、mRNAワクチンを筋注投与したマウス(1個体あたり1 μg)との比較では、有意差は認められませんでした。一方、肺胞洗浄液中のIgA抗体価については、mRNAワクチン投与群と比較しても有意に高い値を示しました。これらの結果は、鼻腔および肺で増殖するウイルスに対して、IgA抗体を介した粘膜免疫応答が誘導されていることを示唆しています。
加えて、肺におけるT細胞免疫応答も評価しました。T細胞免疫は、S蛋白質に限らず、非構造蛋白質を含む他のウイルス蛋白質も認識でき、より広範な抗原に対する応答が可能で、重症化を予防するのに重要と考えられています。ΔEMウイルス接種4週間後のマウス肺では、S蛋白質を標的とするT細胞が有意に増加しており、その効果は高用量のmRNA ワクチン(1個体あたり1 μg)と同等でした。さらに、ΔEMウイルスワクチンは既存のmRNAワクチンで誘導されないN蛋白質に反応するT細胞も有意に誘導しました。これらの結果は、ΔEMウイルスワクチンが感染局所で、複数のウイルス蛋白質に対するT細胞応答を誘導できることを示唆しています。
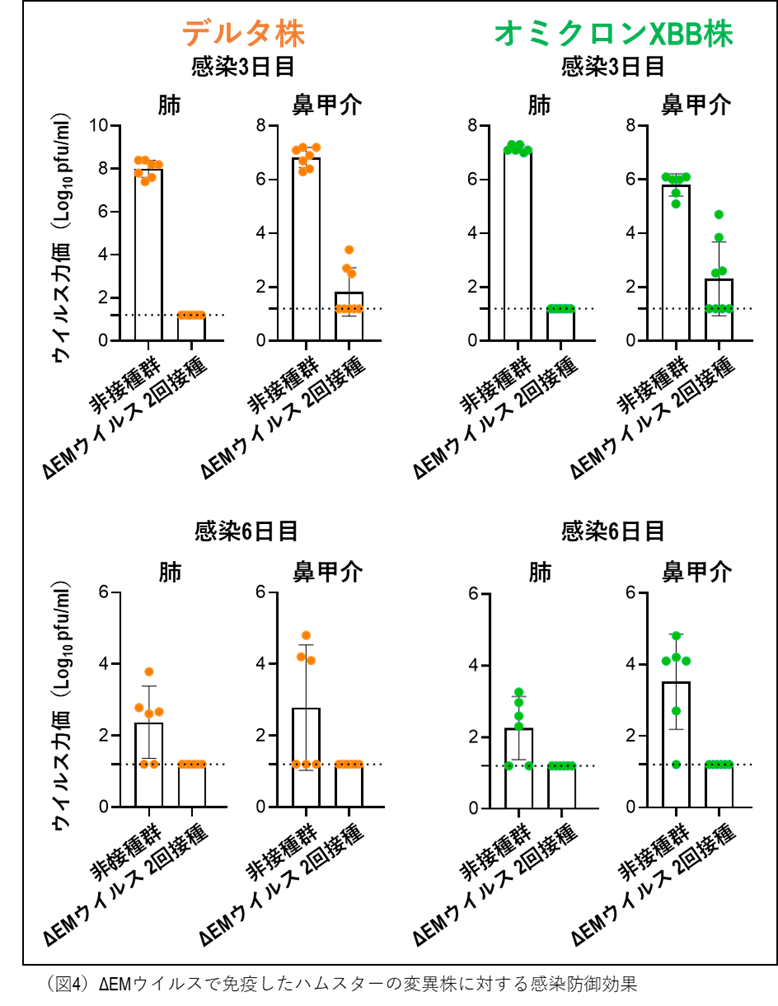
最後に、変異株であるデルタ株(注3)およびオミクロンXBB株(注4)に対する防御効果を、ハムスターモデルを用いて評価しました。ΔEMウイルスを2回接種したハムスターに病原性が強いことが知られているデルタ株(8 x 104 pfu)または起源株から抗原性が大きく変化したオミクロンXBB株(1 x 105 pfu)を感染させ、肺及び鼻甲介におけるウイルス力価を測定しました(図4)。非接種群では、感染3日後の時点で、肺および鼻腔の両方から高力価のウイルスが検出されました。これに対し、ΔEMウイルス接種群では、肺においては両ウイルス株ともに全個体(各群n = 8)からウイルスは検出されませんでした。鼻腔においても、デルタ株では5/8個体、オミクロンXBB株では4/8個体でウイルスは検出されず、残りの個体でもウイルス量は著しく抑制されていました。さらに、鼻腔で検出されたウイルスも、感染6日目までに完全に消失しました。これらの結果は、ΔEMウイルスワクチンが変異株に対しても有効であり、ウイルスの早期排除と回復の促進に寄与することを示唆しています。また、用いたΔEMウイルスワクチンが起源株を基にしているにもかかわらず、抗原性が大きく変化したオミクロンXBB株に対しても有効であったことは高く評価されます。
以上のことから、本半生コロナワクチンは、変異株の継続的な流行が懸念される新型コロナウイルス感染症において、感染拡大防止に資する有力なワクチンプラットフォームの一つとなることが期待されます。
本研究は5月14日(日本時間)、英国科学誌「Nature Communications」(オンライン版)に公表されました。
発表者
東京大学国際高等研究所 新世代感染症センター
河岡 義裕 特任教授/機構長
兼:
国立健康危機管理研究機構 国立国際医療研究所 国際ウイルス感染症研究センター センター長
東京大学医科学研究所 ウイルス感染部門 特任教授
研究助成
本研究は、東京大学国際高等研究所 新世代感染症センター、国立健康危機管理研究機構 国立国際医療研究所、東京大学医科学研究所、米国ウィスコンシン大学が共同で実施し、日本医療研究開発機構(AMED)、新興・再興感染症研究基盤創生事業 (中国拠点を基軸とした新興・再興および輸入感染症制御に向けた基盤研究)、AMED SCARDAワクチン開発のための世界トップレベル研究開発拠点の形成事業 (ワクチン開発のための世界トップレベル研究開発拠点群 東京フラッグシップキャンパス(東京大学新世代感染症センター))、ならびにAMED SCARDA ワクチン・新規モダリティ研究開発事業(非増殖型「半生ウイルス」を基盤とした新型コロナワクチンの研究開発)の一環として行われました。用語解説
(注1)半生ウイルスワクチン弱毒生ウイルスワクチンとは異なり、ウイルスの複製能力が制限されているウイルスワクチン。感染個体において、本来のウイルスと同様の標的細胞に感染し、細胞内でウイルス蛋白質やウイルスゲノムの合成は行われるが、感染性を持つ新たなウイルス粒子は形成されない。そのため、安全性がより高く、かつ本来のウイルスに感染したときと同様の免疫を誘導する。生ワクチンと不活化ワクチンの中間的な特徴を併せ持つ。
(注2)PFU(Plaque Forming Unit)
プラーク形成単位。培養細胞系において、ウイルス感染によって形成されるプラーク(感染によって細胞が死滅し、斑点状の穴として観察される領域)の数に基づき算出される感染性ウイルス粒子の数。ウイルス力価の指標として用いられる。例えば、1 x 105 pfu/mlの場合、ウイルス液1mlあたりに1 x 105個のプラーク(感染による細胞死)を形成させる感染性ウイルス粒子が含まれることを示す。
(注3)デルタ株
2021年に世界的に流行した新型コロナウイルスの変異株で、B.1.617.2系統に属する。起源株と比較して感染力が非常に高く、重症化率も上昇したことが報告されている。
(注4)オミクロンXBB株
スパイク蛋白質を中心に多数の変異を有するオミクロン株の亜系統で、XBB系統に属する。複数のオミクロン亜系統同士(BJ.1系統とBM.1.1.1系統)が組み換えを起こして生じた変異株である。起源株とは抗原性が大きく異なるため、起源株に対するワクチン接種後や自然感染後でも再感染しやすい特性を有するが、重症化リスクは比較的低いとされている。
論文情報
Makoto Kuroda*, Peter J. Halfmann*, Ryuta Uraki*, Seiya Yamayoshi, Taksoo Kim, Tammy A. Armbrust, Sam Spyra, Randall Dahn, Lavanya Babujee, and Yoshihiro Kawaoka¶, "SARS-CoV-2 virus lacking the envelope and membrane open-reading frames as a vaccine platform," Nature Communications 16, Article number: 4453: 2025年5月14日, doi:10.1038/s41467-025-59533-4.
論文へのリンク (掲載誌 )
)
お問い合わせ先
〈研究に関する問合せ〉
東京大学国際高等研究所 新世代感染症センター
河岡 義裕(かわおか よしひろ) 特任教授/機構長
兼:
国立健康危機管理研究機構 国立国際医療研究所 国際ウイルス感染症研究センター センター長
東京大学 医科学研究所ウイルス感染部門 特任教授
東京大学国際高等研究所 新世代感染症センター
河岡 義裕(かわおか よしひろ) 特任教授/機構長
兼:
国立健康危機管理研究機構 国立国際医療研究所 国際ウイルス感染症研究センター センター長
東京大学 医科学研究所ウイルス感染部門 特任教授





