新型コロナウイルスXBB.1.5型RBDを発現するmRNAワクチンの抗原性の異なるJN.1株に対する有効性の検証研究成果
- 新型コロナウイルス(SARS-CoV-2)の受容体結合ドメイン(RBD)のみを発現するmRNAワクチンの有効性を検証した。
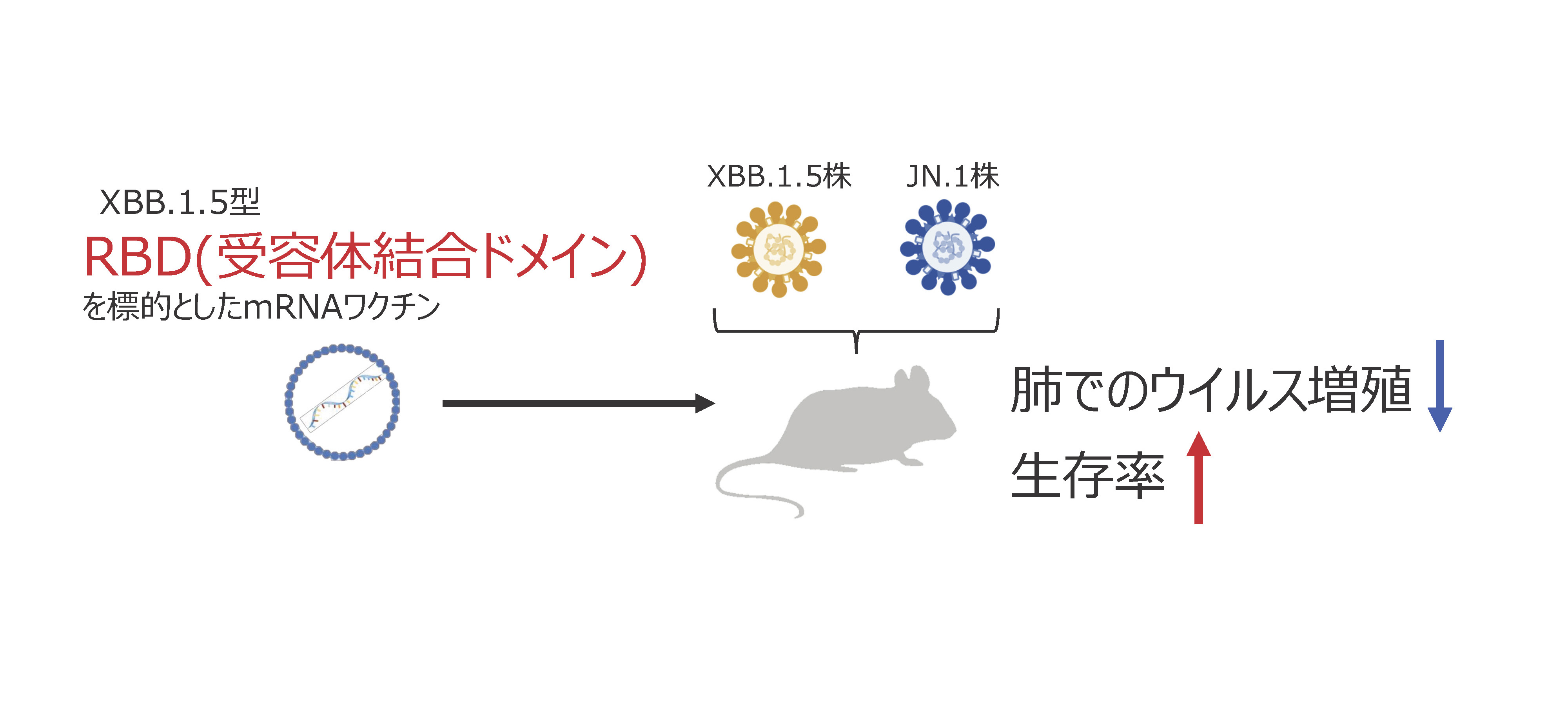
- 今回検証したXBB.1.5型RBDのみを発現するmRNAワクチンを、ブースターワクチンとして接種した際に、抗原性が一致するXBB.1.5株のみならず、抗原性が大きく変化したオミクロンJN.1株に対しても、細胞性免疫および中和抗体を誘導した。
- XBB.1.5型RBDのみを発現するmRNAワクチンは、ブースターワクチンとして接種した際に、抗原性が大きく変化したオミクロンJN.1株に対しても、肺でのウイルス増殖を抑制した。よって、本ワクチンは抗原性が異なるウイルスに対しても有効であることが示された。
発表内容
東京大学 国際高等研究所 新世代感染症センター 河岡義裕 機構長、浦木隆太客員准教授らの研究グループおよび第一三共株式会社は、マウスモデルを用いて、新型コロナウイルス(以下、SARS-CoV-2)の受容体結合ドメイン(RBD)のみを発現するmRNAワクチンの有効性を検証し、本mRNAワクチンが有用であることを示しました。新型コロナウイルス感染症(COVID-19)に対するワクチンの一つとして、日本国内をはじめ、世界的にmRNAワクチンが使用されています。既存のmRNAワクチンでは、SARS-CoV-2のスパイクタンパク質の全長を抗原として発現するようにデザインされています。一方で、感染時に誘導される中和能を有する抗体の多くが、スパイクタンパク質のRBDを認識することが知られています。そこで本グループは、多くの中和抗体(注1)の標的となるRBDのみを発現するmRNAワクチンを作製し、その有効性を示してきました(Uraki et al., npj Vaccines, 2024)。
本研究では、研究開始時(2023年)にWHOがワクチン株として推奨していたXBB.1.5系統(注2)のRBDを発現するmRNAワクチン(以下、XBB.1.5型RBD-mRNAワクチン)を作製し、ブースターワクチンとして使用した場合の効果を検証することを目的とし、免疫誘導能や感染防御効果について評価しました。
ヒトACE2発現マウスに、初回のワクチンとして起源型RBD-mRNAワクチン、もしくは起源型RBD-mRNAとBA.5型RBD-mRNAの混合2価ワクチンで免疫し、その3週間後にブースターワクチンとしてXBB.1.5型RBD-mRNAワクチンを投与しました。2回の免疫後に抗原特異的T細胞の応答を検証した結果、免疫に用いた起源株およびXBB.1.5系統のスパイクタンパク質だけでなく、抗原性が異なるBA.2.86系統(注3)のスパイクタンパク質に対しても抗原特異的なT細胞応答が誘導されていました。
次に中和抗体について検証したところ、ブースターワクチンとしてXBB.1.5型RBD-mRNAワクチンを接種したマウスでは、XBB.1.5株に対する中和抗体が誘導されていました。また、初回ワクチンとして起源型RBD-mRNAとBA.5型RBD-mRNAの混合2価ワクチンを接種した群では、抗原性が大きく異なるBA.2.86系統の子孫系統であるJN.1系統の株に対する中和抗体も、多くの個体で誘導されていました(図1)。

続いて、これらのマウスにXBB.1.5株またはJN.1株を感染させ、感染防御効果について検証を行いました。
XBB.1.5株を感染させた際には、OVA-mRNA接種群および起源株のみで免疫を行った群では顕著な体重減少がみられ、多くの個体が死亡しました。一方、ブースターワクチンとしてXBB.1.5型RBD-mRNAワクチンを接種したマウスでは体重の減少はみられず、すべての個体が生存しました。また、呼吸器におけるウイルス量を測定したところ、XBB.1.5型RBD-mRNAワクチンを接種したマウスでは、OVA-mRNA接種群および起源株のみで免疫を行った群に比べ、感染2日後および5日後のウイルス増殖が強く抑制されていました(図2上)。
JN.1株を感染させた際には、OVA-mRNA接種群を含め、いずれのマウスもほとんど体重減少を示しませんでした。呼吸器のウイルス量を比較したところ、ブースターワクチンとしてXBB.1.5型RBD-mRNAワクチンを接種したマウスでは、感染5日後の肺におけるウイルス量が抑制されており、さらに、初回ワクチンとして起源型RBD-mRNAとBA.5型RBD-mRNAの混合2価ワクチンを接種した群では、感染2日後のウイルス量もOVA-mRNA接種群より抑制されていることが明らかとなりました(図2下)。

本研究は6月6日、英国科学誌「eBioMedicine」(オンライン版)に公表されました。
発表者
東京大学 国際高等研究所 新世代感染症センター河岡 義裕 特任教授/機構長
兼:国立健康危機管理研究機構 国立国際医療研究所 国際ウイルス感染症研究センター センター長
東京大学 医科学研究所 ウイルス感染部門 特任教授
東京大学 国際高等研究所 新世代感染症センター
浦木 隆太 客員准教授
兼:国立健康危機管理研究機構 国立国際医療研究所 国際ウイルス感染症研究センター 主任研究員
東京大学 医科学研究所 ウイルス感染部門 特任研究員
研究助成
本研究は、東京大学 国際高等研究所 新世代感染症センターが、国立健康危機管理研究機構 国立国際医療研究所、東京大学医科学研究所、米国ウィスコンシン大学、エモリー大学、Nezu Biotech GmbHの協力のもと、第一三共株式会社と共同で実施し、日本医療研究開発機構(AMED)、新興・再興感染症研究基盤創生事業 (中国拠点を基軸とした新興・再興および輸入感染症制御に向けた基盤研究)、AMED SCARDAワクチン開発のための世界トップレベル研究開発拠点の形成事業 (ワクチン開発のための世界トップレベル研究開発拠点群 東京フラッグシップキャンパス(東京大学新世代感染症センター))、ならびにAMED 新型コロナウイルス感染症(COVID-19)に対するワクチン開発(新型コロナウイルス感染症(COVID-19)に対するmRNAワクチン開発)の一環として行われました。用語解説
(注1)中和抗体ウイルスの細胞への感染を阻害する機能を持つ抗体。
(注2)XBB.1.5系統
スパイク蛋白質を中心に多数の変異を有するオミクロン株の亜系統で、XBB系統から派生した変異株である。起源株とは抗原性が大きく異なるため、起源株に対するワクチン接種後や自然感染後でも再感染しやすい特性を有するが、重症化リスクは比較的低いとされている。
(注3)BA.2.86系統
スパイク蛋白質を中心に多数の変異を有するオミクロン株の亜系統で、2023年8月に出現したオミクロンBA.2系統の子孫系統である。オミクロンBA.2系統と比較して、スパイクタンパク質に30ヶ所以上もの変異を有し、それ以前の主流系統であったXBB.1.5系統と抗原性が大きく異なる。
論文情報
Ryuta Uraki*¶, Maki Kiso, Mutsumi Ito, Seiya Yamayoshi, Peter Halfmann, Shilpi Jain, Mehul S. Suthar, Tiago J.S. Lopes, Nao Jounai, Kazuki Miyaji, Fumihiko Takeshita, and Yoshihiro Kawaoka¶, "An mRNA vaccine encoding the SARS-CoV-2 Omicron XBB.1.5 receptor-binding domain protects mice from the JN.1 variant," eBioMedicine: 2025年6月6日, doi:10.1016/j.ebiom.2025.105794.
論文へのリンク (掲載誌 )
)
お問い合わせ先
〈研究に関する問合せ〉
東京大学国際高等研究所 新世代感染症センター
河岡 義裕(かわおか よしひろ) 特任教授/機構長
兼:国立健康危機管理研究機構 国立国際医療研究所 国際ウイルス感染症研究センター センター長
東京大学 医科学研究所ウイルス感染部門 特任教授
東京大学 国際高等研究所 新世代感染症センター
浦木 隆太(うらき りゅうた) 客員准教授
兼:国立健康危機管理研究機構 国立国際医療研究所 国際ウイルス感染症研究センター 主任研究員
東京大学 医科学研究所 ウイルス感染部門 特任研究員
〈報道に関する問合せ〉
東京大学 国際高等研究所 新世代感染症センター(広報)
https://www.utopia.u-tokyo.ac.jp/contact





